kilde SHP1 ve SHP2'yi içeren tirozin fosfataz-
lar tarafindan da inhibe edilebilirler.
ponektin reseptörü tanimlanmitir. Bu resep-
törler farkli genler tarafindan kodlanir ve ara-
larinda amino asit dizilimi bakimindan %67
oraninda bir benzerlik bulunur.
membran domainden oluur. Reseptörler,
GPCR'ye zit olan geometrik bir yapiya sahiptir
(AdipoR1/R2'de N-terminal uç zarin içinde ve
C-terminal uç zarin diindadir). Bu reseptörler
G proteini vasitasiyla sinyal oluturmazlar (
meostazisini düzenleyen ya dokusu kaynakli
bir hormon).
Proteolitik bir yikimdan sonra daha küçük
bir boyutta veya yuvarlak parçalar halinde de
olabilir. Obezite hem plazma adiponektin dü-
zeyini hem de çevre dokularda insülin diren-
cine yol açan AdipoR1/R2'nin ekspresyonunu
azaltir.
olur (yeniden beslenme ile azalir). Bu reseptör
AMPK'yi aktive ederek, enerji harcanmasini
azaltir ve gida alimini uyarir.
davranir ve DNA'ya balanan transkripsiyon
faktörleri üzerinden biyolojik yanitlara neden
olur. Reseptörün uyarilmasindan sonra sinyal
akiminin iletilmesi esasina dayali kompleks
bir mekanizmaya sahip olan membran resep-
törlerinin tersine, nükleer reseptörler gen pro-
moterlerine yakin bölgelerle etkileir ve özel
genlerin ekspresyonunu düzenlerler.
lerin trankripsiyon hizini arttiran veya azaltan
çok sayida koaktivatör ve korepresör de ta-
nimlanmitir.
id, tiroid ve lipofilik hormon reseptörleri olarak
dört alt gruba ayrilirken, filogenetik bulgulara
göre; tip I "steroid reseptörler" (östrojenler,
projestinler, androjenler, glukokortikoidler ve
mineralokortikodileri içerir) ve tip II (all-trans
retinoik aist, 9-cis retinoik asit, tiroid hormonu
ve D
"orfan-kabullenilmi" reseptörler oluturur.
rin endojen bir substrata balanma affinitesine
sahip olduu gösterilmi ve reseptör grubunun
adi "orfan-kabullenilmi" olarak deitirilmi-
tir. Örnein, peroksizom-proliferatör-aktivatör
reseptörü (PPAR-) kolesterol düürücü bir ilaç
olan fibratlar için tanimlanan ilk reseptördür.
Bu reseptörün daha sonra endojen ligand olarak
ya asitlerine balandii bulunmutur. Nükleer
reseptörlerin son bir grubunu "orfan" trankrip-
siyon faktörleri oluturur. Adrenal steroidoge-
nezin anahtar bir düzenleyicisi olan steroidoje-
nik faktör-1 (SF-1), pankreas beta-hücre ilevini
etkileyen hepatosit nükleer faktör-4 (HNF-4)
ve doza baimli cinsiyet dönüümü X kromozo-
mu gen 1 üzerinde konjenital Adrenal hipoplazi
için kritik bölge (DAX-1) "orfan" trankripsiyon
faktörlerindendir. Bu reseptörlerin temel özelli-
i endojen ligandlarinin olmamasidir.
arasinda deiir. Bu reseptörler N-terminal dü-
zenleyici domain, DNA-balayici domain, ana
gövde, ligand balayici domain ve C-terminal
domain olmak üzere be bölgeden oluan mo-
düler bir yapiya sahiptir. N-terminal domain
bölgenin amino asit dizilimi ve yapisi nükleer
reseptörler arasinda oldukça farklidir. Bazi re-
septörlerde N-terminal domain bir AF1 (akti-
vasyon fonksiyonu) domain içerir. Tek baina
AF1'in transkripsiyon aktivasyonu üzerine
olan etkisi normal olarak zayiftir. Bununla bir-
likte, AF1 ligand-bali domainin içinde bulu-
nan AF2 ile birlikte sinerjik bir etki göstererek,
bu fonksiyonunu güçlendirebilir.
amino asitten oluan iki polipeptid halkaya
sahiptir. Bu yapi ya iki sistin/iki histidin mo-
lekülünden ya da tek bir çinko atomuna kari-
lik dört sistein molekülünden oluur. Nükleer
DNA üzerinde reseptör için hedef genler bu-
lunur. Genlerin promoter ve düzenleyici böl-
gelerinde bulunan hormon-cevapli elementler
ile reseptördeki "çinko parmaklar" karilikli
olarak birbirine balanir. DNA-bali domain
hücre içi trafii etkileyen ve farkli uzunlukta
olan bir ana gövde tarafindan ligand-bali do-
main ile irtibatlandirilir. Ligand-bali domain;
hormon balama, reseptör dimerizasyonu ve
trankripsiyonun balatilmasindan sorumludur.
dimerizasyon ile sonuçlan¿r.
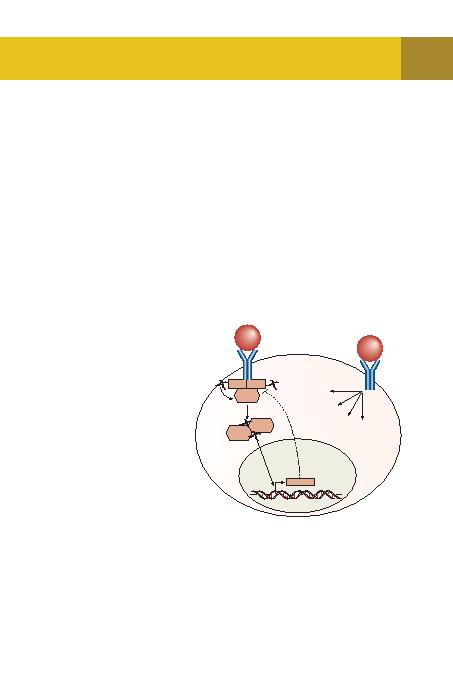
bir rotasyona neden olduöunu göstermektedir. Söz konusu rotasyon, birbiri ile irtibatl¿ iki JAK molekülü-
nün fosfatlanmas¿n¿ ve birbirlerini aktive edecek düzeyde yukar¿ doöru yükselmelerini saölar.
lanan, kendi kendine dimerize olan ve daha sonra nükleusa geçen bir moleküldür. STAT nükleusta
bir transkripsiyon faktörü olarak çal¿ù¿r ve birden fazla hedef genin transkripsiyonunu baùlat¿r.
dolayl¿ ikincil habercileri de aktive ederler.