Le bénéfice est aussi fonctionnel
Une analyse post-hoc d'AFFIRM a montré par ailleurs que 37% des patients
sous natalizumab ne présentaient pas de poussées à deux ans, ni de
progression soutenue du handicap (12 semaines), ni de lésions prenant le
gadolinium, ni de nouvelle lésion hyperintense en T2 contre 7% seulement
des patients sous placébo (p < 0,0001) (17). Par ailleurs, on constate dans
cette même analyse post-hoc que l'impact du traitement, déjà majeur après
un an, est encore plus important après la deuxième année en termes d'absence
d'activité de la maladie (entre 65% et 70%) (17).
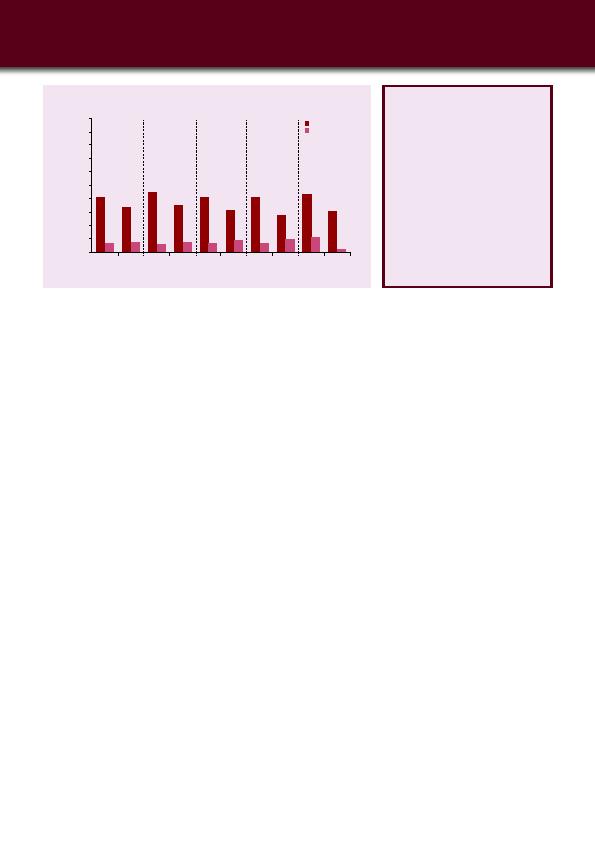
Une autre sous-analyse d'AFFIRM, présentée cette année à l'ECTRIMS par le
Professeur Havrdova, va dans le même sens. Cette analyse, portant sur 924
patients, a confirmé le potentiel du natalizumab pour arrêter l'activité de la
maladie sur un grand groupe de patients. Plus important, cette analyse a aussi
et surtout démontré que le bénéfice du traitement est supérieur lorsque le
score EDSS est < 3 et/ou quand le nombre de poussées était faible au moment
de l'initiation du traitement par natalizumab (21) (
Figure 2).
«Il est primordial de constater l'absence de lésion radiologique, souligne
le Professeur Gavin Giovannoni,
car, même en l'absence de symptômes
cliniques, une progression radiologique traduit une réaction inflammatoire et
immunitaire de l'organisme. Or la plasticité du cerveau a des limites...»
Une analyse post-hoc des études AFFIRM et SENTINEL a également montré la
capacité du natalizumab à améliorer la qualité de vie (score SF-36) (19), ce qui
s'observe aussi au quotidien de manière significative, tant sur le plan physique
que psychologique, comme l'a montré le registre suédois portant sur 1.152
patients suivis durant 24 mois (2).
Le bénéfice se retrouve dans toutes les circonstances
Comme indiqué précédemment, il est possible d'atteindre un tableau
clinique stable pour une bonne partie des patients sous natalizumab et
une diminution conséquente du nombre de poussées. Si de nouvelles
poussées surviennent malgré tout, il peut être intéressant d'en évaluer
les conséquences éventuelles. Dans une sous-analyse récente d'AFFIRM,
la sévérité des poussées et leur récupération ont ainsi été examinées.
Cette sous-analyse a montré que la poursuite du natalizumab permet une
rémission complète des poussées dans 76,0% des cas (contre 43,1% sous
placébo, HR = 1,673, p = 0,0319) (20). Et cette rémission a d'autant plus
de chances d'être observée que le score EDSS est faible,
«ce qui souligne
l'intérêt de proposer le natalizumab tôt dans le cours de la maladie»,
souligne le Professeur Giovannoni.
Les effets secondaires peuvent être mieux appréhendés
On connaît la problématique de la positivité pour le virus JC, le risque étant
très faible (1/10.000) chez les patients négatifs pour les anticorps anti-JCV
est faible au cours des deux premières années en cas de présence d'anticorps
anti-JCV*
1/1.000) (22). Au-delà de deux ans, la décision de traiter doit être
prise au cas par cas (voir
encadré). Pour les patients anti-JCV positifs, une
surveillance IRM adaptée est nécessaire (24). L'IRM est par ailleurs un support
crucial pour détecter précocement une Leuco Encéphalopathie Multifocale
Progressive (LEMP) (avant tout symptôme clinique) (24). Il a été démontré
que les patients dont la LEMP a été détectée précocement (avant l'apparition
de symptômes) ont un taux de survie meilleur et un handicap fonctionnel
moindre comparé aux patients avec une LEMP symptomatique (23).
TRAITER TÔT, C'EST MIEUX TRAITER
L'équation paraît simple, encore fallait-il l'étayer. Ce qui permettait au
Professeur Giovannoni de conclure en disant que chez la plupart des patients
ayant une réponse inadéquate aux traitements de première ligne:
·
le natalizumab peut améliorer la fatigue, la cognition, la fonction vésicale,
la qualité de vie (1-4);
·
un score EDSS stable est souvent observé chez des patients sous
natalizumab (26-27);
·
L'absence d'activité de la maladie sous natalizumab a été rapportée dans
37% des cas et ce pourcentage augmente chez les patients traités tôt au
cours de leur maladie (17, 21).
Références
1.
Svenningsson A, et al. PLoS One 2013;8:e58643).
2.
Holmén C, et al. Mult Scler 2011;17:708-19.
3.
Weinstock-Guttmanen B, et al. J Neurol 2012;259:898-905. (cognition)
4.
Khatri B, et al. Presented at ECTRIMS; October 1922, 2011; Amsterdam, The Netherlands, P1040.
5
Leray E, et al. Brain 2010;133(Pt 7):1900-13.
6.
Tedeholm H, et al. Mult Scler 2013;19(6):765-74.
7.
Orme M, et al. Value Health 2007;10(1):54-60.
8.
Freedman M, et al. Can J Neurol Sci 2013;40(3):307-23.
9.
Sormani M, et al. Mult Scler 2013;19(5):605-12.
10.
Sormani M, et al. Nat Rev Neurol 2013;9:504-12.
11.
Freedman M, Forrestal F. Mult Scler 2008;14(9):1234-41.
12.
Miller J. J Manag Care Pharm 2004;10(3 Suppl B):S4-11.
13.
Rao S, et al. Neurology 1991;41(5):692-6.
14.
Pfleger C, et al. Mult Scler 2010;16(1):121-6.
15.
Kingwell E, et al. J Neurol Neurosurg Psychiatry 2012;83(1):61-6.
16.
Polman C, et al. N Engl J Med 2006;354(9):899-910.
17.
Havrdova E, et al. Lancet Neurol 2009;8(3):254-60.
18.
Philips J, et al. Mult Scler 2011;17(8):970-9.
19.
Rudick R, et al. Ann Neurol 2007;62(4):335-46.
20.
Lublin F, et al. ECTRIMS 2013. Abstract#P524.
21.
Havrdova E, et al. ECTRIMS 2013. Abstract#P519.
22.
http://www.biogenidecinternational.com/tysabri.aspx?ID=4763, password protected via Doc Check and
accessible by doctors only.
23.
Dong-Si, et al. AAN 2013. Abstract#P04.271.
24.
Wattjes, et al. Mult Scler 2013;0(0):115.
25.
Belgisch Staatsblad. Hoofdstuk IV paragraaf 4410000. Geraadpleegd op 21 September 2012, http://www.
staatsblad.be
26.
Kappos L, et al. Presented at ENS; June 912, 2012; Prague, Czech Republic. O261.
27.
Kallweit U, et al. Clin Neuropharmacol 2012;35:77-80.
*P < 0,0001; **P = 0,0005
0
10
20
30
40
50
60
70
80
90
100
P
a
tien
ts (%)
n =
255 113
345 191
87 50
513 254
355 181
245 123
401 207
199 97
284 165
315 138
< 35*
35*
< 2*
2*
1*
2*
< 3,0
3,0**
0*
1*
Age, years
Disease duration, years
Relapses in the past year
EDSS scoreGd+ lesions
Subgroup
Natalizumab
Placebo
40,8
33,6
44,8
35,3
40,8
30,6
40,9
28,1
43,3
30,8
7,1
7,3
6,0
7,5
6,6
8,1
6,3
9,3
11,5
2,2
Figure 2: Proportion de patients libres de toute activité de la maladie,
par sous-groupes d'activité (AFFIRM) (21).
Selon le Professeur Giovannoni, la
prise de décision de poursuivre le
traitement par natalizumab après
2 ans chez les patients anti-JVC+
dépend notamment:
·
du risque individuel de développer
une LEMP,
·
de l'activité de la maladie avant
traitement,
·
de la réponse thérapeutique au
natalizumab et du risque potentiel
de reprise de la maladie en cas
d'arrêt du traitement,
·
du choix du patient.
* Pour les patients n'ayant pas été traités préalablement par des immunosuppresseurs.
NC502F.indd 2
25/11/13 09:41
