- Page 1
- Page 2
- Page 3
- Page 4
- Page 5
- Page 6
- Page 7
- Page 8
- Page 9
- Page 10
- Page 11
- Page 12
- Page 13
- Page 14
- Page 15
- Page 16
- Page 17
- Page 18
- Page 19
- Page 20
- Page 21
- Page 22
- Page 23
- Page 24
- Page 25
- Page 26
- Page 27
- Page 28
- Page 29
- Page 30
- Page 31
- Page 32
- Page 33
- Page 34
- Page 35
- Page 36
- Page 37
- Page 38
- Page 39
- Page 40
- Page 41
- Page 42
- Page 43
- Page 44
- Page 45
- Page 46
- Page 47
- Page 48
- Page 49
- Page 50
- Page 51
- Page 52
- Page 53
- Page 54
- Page 55
- Page 56
- Page 57
- Page 58
- Page 59
- Page 60
- Page 61
- Page 62
- Page 63
- Page 64
- Page 65
- Page 66
- Page 67
- Page 68
- Page 69
- Page 70
- Flash version
© UniFlip.com
- Page 2
- Page 3
- Page 4
- Page 5
- Page 6
- Page 7
- Page 8
- Page 9
- Page 10
- Page 11
- Page 12
- Page 13
- Page 14
- Page 15
- Page 16
- Page 17
- Page 18
- Page 19
- Page 20
- Page 21
- Page 22
- Page 23
- Page 24
- Page 25
- Page 26
- Page 27
- Page 28
- Page 29
- Page 30
- Page 31
- Page 32
- Page 33
- Page 34
- Page 35
- Page 36
- Page 37
- Page 38
- Page 39
- Page 40
- Page 41
- Page 42
- Page 43
- Page 44
- Page 45
- Page 46
- Page 47
- Page 48
- Page 49
- Page 50
- Page 51
- Page 52
- Page 53
- Page 54
- Page 55
- Page 56
- Page 57
- Page 58
- Page 59
- Page 60
- Page 61
- Page 62
- Page 63
- Page 64
- Page 65
- Page 66
- Page 67
- Page 68
- Page 69
- Page 70
- Flash version
© UniFlip.com
240
B Ö LÜ M 6
Neoplazi
BRAF inhibitörü
Melanom
BRAF (V600E) mutasyonu
Kolon adenokarsinomu
Tiroid papiller karsinomu
Langerhans hücreli histiyositoz
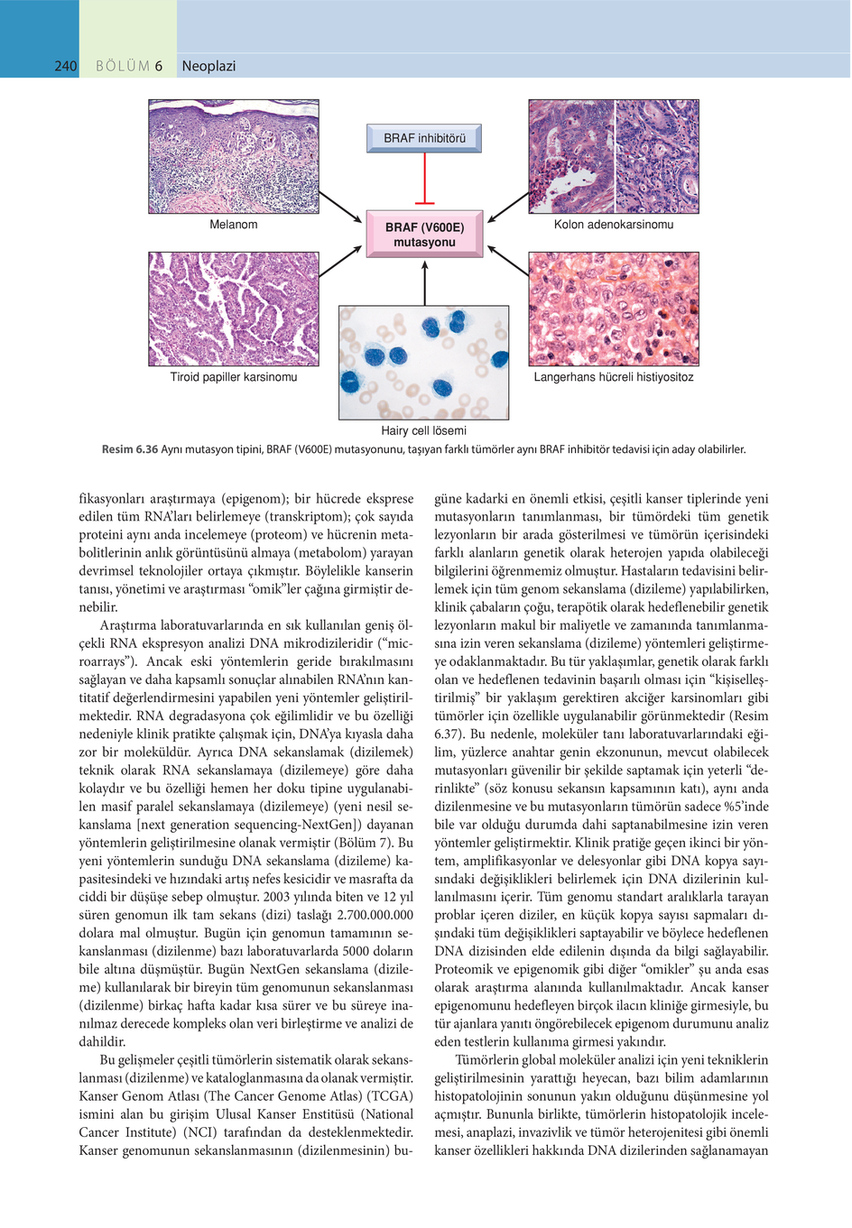
Hairy cell lösemi Resim 6.36 Aynı mutasyon tipini, BRAF (V600E) mutasyonunu, taşıyan farklı tümörler aynı BRAF inhibitör tedavisi için aday olabilirler.
fikasyonları araştırmaya (epigenom); bir hücrede eksprese edilen tüm RNA’ları belirlemeye (transkriptom); çok sayıda proteini aynı anda incelemeye (proteom) ve hücrenin metabolitlerinin anlık görüntüsünü almaya (metabolom) yarayan devrimsel teknolojiler ortaya çıkmıştır. Böylelikle kanserin tanısı, yönetimi ve araştırması “omik”ler çağına girmiştir denebilir. Araştırma laboratuvarlarında en sık kullanılan geniş ölçekli RNA ekspresyon analizi DNA mikrodizileridir (“microarrays”). Ancak eski yöntemlerin geride bırakılmasını sağlayan ve daha kapsamlı sonuçlar alınabilen RNA’nın kantitatif değerlendirmesini yapabilen yeni yöntemler geliştirilmektedir. RNA degradasyona çok eğilimlidir ve bu özelliği nedeniyle klinik pratikte çalışmak için, DNA’ya kıyasla daha zor bir moleküldür. Ayrıca DNA sekanslamak (dizilemek) teknik olarak RNA sekanslamaya (dizilemeye) göre daha kolaydır ve bu özelliği hemen her doku tipine uygulanabilen masif paralel sekanslamaya (dizilemeye) (yeni nesil sekanslama [next generation sequencing-NextGen]) dayanan yöntemlerin geliştirilmesine olanak vermiştir (Bölüm 7). Bu yeni yöntemlerin sunduğu DNA sekanslama (dizileme) kapasitesindeki ve hızındaki artış nefes kesicidir ve masrafta da ciddi bir düşüşe sebep olmuştur. 2003 yılında biten ve 12 yıl süren genomun ilk tam sekans (dizi) taslağı 2.700.000.000 dolara mal olmuştur. Bugün için genomun tamamının sekanslanması (dizilenme) bazı laboratuvarlarda 5000 doların bile altına düşmüştür. Bugün NextGen sekanslama (dizileme) kullanılarak bir bireyin tüm genomunun sekanslanması (dizilenme) birkaç hafta kadar kısa sürer ve bu süreye inanılmaz derecede kompleks olan veri birleştirme ve analizi de dahildir. Bu gelişmeler çeşitli tümörlerin sistematik olarak sekanslanması (dizilenme) ve kataloglanmasına da olanak vermiştir. Kanser Genom Atlası (The Cancer Genome Atlas) (TCGA) ismini alan bu girişim Ulusal Kanser Enstitüsü (National Cancer Institute) (NCI) tarafından da desteklenmektedir. Kanser genomunun sekanslanmasının (dizilenmesinin) bu-
güne kadarki en önemli etkisi, çeşitli kanser tiplerinde yeni mutasyonların tanımlanması, bir tümördeki tüm genetik lezyonların bir arada gösterilmesi ve tümörün içerisindeki farklı alanların genetik olarak heterojen yapıda olabileceği bilgilerini öğrenmemiz olmuştur. Hastaların tedavisini belirlemek için tüm genom sekanslama (dizileme) yapılabilirken, klinik çabaların çoğu, terapötik olarak hedeflenebilir genetik lezyonların makul bir maliyetle ve zamanında tanımlanmasına izin veren sekanslama (dizileme) yöntemleri geliştirmeye odaklanmaktadır. Bu tür yaklaşımlar, genetik olarak farklı olan ve hedeflenen tedavinin başarılı olması için “kişiselleştirilmiş” bir yaklaşım gerektiren akciğer karsinomları gibi tümörler için özellikle uygulanabilir görünmektedir (Resim 6.37). Bu nedenle, moleküler tanı laboratuvarlarındaki eğilim, yüzlerce anahtar genin ekzonunun, mevcut olabilecek mutasyonları güvenilir bir şekilde saptamak için yeterli “derinlikte” (söz konusu sekansın kapsamının katı), aynı anda dizilenmesine ve bu mutasyonların tümörün sadece %5’inde bile var olduğu durumda dahi saptanabilmesine izin veren yöntemler geliştirmektir. Klinik pratiğe geçen ikinci bir yöntem, amplifikasyonlar ve delesyonlar gibi DNA kopya sayısındaki değişiklikleri belirlemek için DNA dizilerinin kullanılmasını içerir. Tüm genomu standart aralıklarla tarayan problar içeren diziler, en küçük kopya sayısı sapmaları dışındaki tüm değişiklikleri saptayabilir ve böylece hedeflenen DNA dizisinden elde edilenin dışında da bilgi sağlayabilir. Proteomik ve epigenomik gibi diğer “omikler” şu anda esas olarak araştırma alanında kullanılmaktadır. Ancak kanser epigenomunu hedefleyen birçok ilacın kliniğe girmesiyle, bu tür ajanlara yanıtı öngörebilecek epigenom durumunu analiz eden testlerin kullanıma girmesi yakındır. Tümörlerin global moleküler analizi için yeni tekniklerin geliştirilmesinin yarattığı heyecan, bazı bilim adamlarının histopatolojinin sonunun yakın olduğunu düşünmesine yol açmıştır. Bununla birlikte, tümörlerin histopatolojik incelemesi, anaplazi, invazivlik ve tümör heterojenitesi gibi önemli kanser özellikleri hakkında DNA dizilerinden sağlanamayan