- Page 1
- Page 2
- Page 3
- Page 4
- Page 5
- Page 6
- Page 7
- Page 8
- Page 9
- Page 10
- Page 11
- Page 12
- Page 13
- Page 14
- Page 15
- Page 16
- Page 17
- Page 18
- Page 19
- Page 20
- Page 21
- Page 22
- Page 23
- Page 24
- Page 25
- Page 26
- Page 27
- Page 28
- Page 29
- Page 30
- Page 31
- Page 32
- Page 33
- Page 34
- Page 35
- Page 36
- Page 37
- Page 38
- Page 39
- Page 40
- Page 41
- Page 42
- Page 43
- Page 44
- Page 45
- Page 46
- Page 47
- Page 48
- Page 49
- Page 50
- Page 51
- Page 52
- Page 53
- Page 54
- Page 55
- Page 56
- Page 57
- Page 58
- Page 59
- Page 60
- Page 61
- Page 62
- Page 63
- Page 64
- Page 65
- Page 66
- Page 67
- Page 68
- Page 69
- Page 70
- Flash version
© UniFlip.com
- Page 2
- Page 3
- Page 4
- Page 5
- Page 6
- Page 7
- Page 8
- Page 9
- Page 10
- Page 11
- Page 12
- Page 13
- Page 14
- Page 15
- Page 16
- Page 17
- Page 18
- Page 19
- Page 20
- Page 21
- Page 22
- Page 23
- Page 24
- Page 25
- Page 26
- Page 27
- Page 28
- Page 29
- Page 30
- Page 31
- Page 32
- Page 33
- Page 34
- Page 35
- Page 36
- Page 37
- Page 38
- Page 39
- Page 40
- Page 41
- Page 42
- Page 43
- Page 44
- Page 45
- Page 46
- Page 47
- Page 48
- Page 49
- Page 50
- Page 51
- Page 52
- Page 53
- Page 54
- Page 55
- Page 56
- Page 57
- Page 58
- Page 59
- Page 60
- Page 61
- Page 62
- Page 63
- Page 64
- Page 65
- Page 66
- Page 67
- Page 68
- Page 69
- Page 70
- Flash version
© UniFlip.com
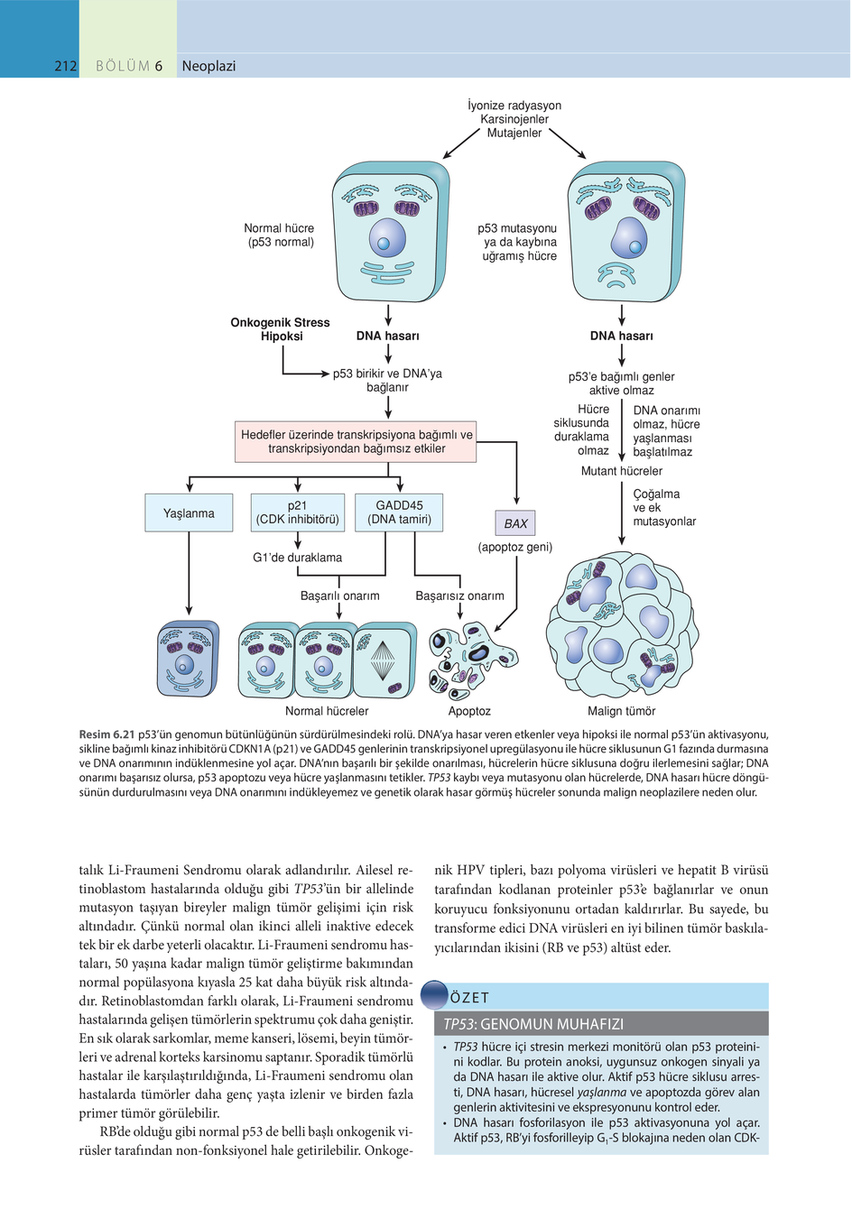
212
B Ö LÜ M 6
Neoplazi
İyonize radyasyon Karsinojenler Mutajenler
Normal hücre (p53 normal)
p53 mutasyonu ya da kaybına uğramış hücre
Onkogenik Stress Hipoksi
DNA hasarı p53 birikir ve DNA’ya bağlanır
DNA hasarı p53’e bağımlı genler aktive olmaz Hücre siklusunda duraklama olmaz DNA onarımı olmaz, hücre yaşlanması başlatılmaz
Hedefler üzerinde transkripsiyona bağımlı ve transkripsiyondan bağımsız etkiler
Mutant hücreler p21 (CDK inhibitörü) G1’de duraklama Başarılı onarım GADD45 (DNA tamiri) Çoğalma ve ek mutasyonlar
Yaşlanma
BAX (apoptoz geni)
Başarısız onarım
Normal hücreler
Apoptoz
Malign tümör
Resim 6.21 p53’ün genomun bütünlüğünün sürdürülmesindeki rolü. DNA’ya hasar veren etkenler veya hipoksi ile normal p53’ün aktivasyonu, sikline bağımlı kinaz inhibitörü CDKN1A (p21) ve GADD45 genlerinin transkripsiyonel upregülasyonu ile hücre siklusunun G1 fazında durmasına ve DNA onarımının indüklenmesine yol açar. DNA’nın başarılı bir şekilde onarılması, hücrelerin hücre siklusuna doğru ilerlemesini sağlar; DNA onarımı başarısız olursa, p53 apoptozu veya hücre yaşlanmasını tetikler. TP53 kaybı veya mutasyonu olan hücrelerde, DNA hasarı hücre döngüsünün durdurulmasını veya DNA onarımını indükleyemez ve genetik olarak hasar görmüş hücreler sonunda malign neoplazilere neden olur.
talık Li-Fraumeni Sendromu olarak adlandırılır. Ailesel retinoblastom hastalarında olduğu gibi TP53’ün bir allelinde mutasyon taşıyan bireyler malign tümör gelişimi için risk altındadır. Çünkü normal olan ikinci alleli inaktive edecek tek bir ek darbe yeterli olacaktır. Li-Fraumeni sendromu hastaları, 50 yaşına kadar malign tümör geliştirme bakımından normal popülasyona kıyasla 25 kat daha büyük risk altındadır. Retinoblastomdan farklı olarak, Li-Fraumeni sendromu hastalarında gelişen tümörlerin spektrumu çok daha geniştir. En sık olarak sarkomlar, meme kanseri, lösemi, beyin tümörleri ve adrenal korteks karsinomu saptanır. Sporadik tümörlü hastalar ile karşılaştırıldığında, Li-Fraumeni sendromu olan hastalarda tümörler daha genç yaşta izlenir ve birden fazla primer tümör görülebilir. RB’de olduğu gibi normal p53 de belli başlı onkogenik virüsler tarafından non-fonksiyonel hale getirilebilir. Onkoge-
nik HPV tipleri, bazı polyoma virüsleri ve hepatit B virüsü tarafından kodlanan proteinler p53’e bağlanırlar ve onun koruyucu fonksiyonunu ortadan kaldırırlar. Bu sayede, bu transforme edici DNA virüsleri en iyi bilinen tümör baskılayıcılarından ikisini (RB ve p53) altüst eder.
ÖZET
TP53: GENOMUN MUHAFIZI
• TP53 hücre içi stresin merkezi monitörü olan p53 proteinini kodlar. Bu protein anoksi, uygunsuz onkogen sinyali ya da DNA hasarı ile aktive olur. Aktif p53 hücre siklusu arresti, DNA hasarı, hücresel yaşlanma ve apoptozda görev alan genlerin aktivitesini ve ekspresyonunu kontrol eder. • DNA hasarı fosforilasyon ile p53 aktivasyonuna yol açar. Aktif p53, RB’yi fosforilleyip G1-S blokajına neden olan CDK-