- Page 1
- Page 2
- Page 3
- Page 4
- Page 5
- Page 6
- Page 7
- Page 8
- Page 9
- Page 10
- Page 11
- Page 12
- Page 13
- Page 14
- Page 15
- Page 16
- Page 17
- Page 18
- Page 19
- Page 20
- Page 21
- Page 22
- Page 23
- Page 24
- Page 25
- Page 26
- Page 27
- Page 28
- Page 29
- Page 30
- Page 31
- Page 32
- Page 33
- Page 34
- Page 35
- Page 36
- Page 37
- Page 38
- Page 39
- Page 40
- Page 41
- Page 42
- Page 43
- Page 44
- Page 45
- Page 46
- Page 47
- Page 48
- Page 49
- Page 50
- Page 51
- Page 52
- Page 53
- Page 54
- Page 55
- Page 56
- Page 57
- Page 58
- Page 59
- Page 60
- Page 61
- Page 62
- Page 63
- Page 64
- Page 65
- Page 66
- Page 67
- Page 68
- Page 69
- Page 70
- Flash version
© UniFlip.com
- Page 2
- Page 3
- Page 4
- Page 5
- Page 6
- Page 7
- Page 8
- Page 9
- Page 10
- Page 11
- Page 12
- Page 13
- Page 14
- Page 15
- Page 16
- Page 17
- Page 18
- Page 19
- Page 20
- Page 21
- Page 22
- Page 23
- Page 24
- Page 25
- Page 26
- Page 27
- Page 28
- Page 29
- Page 30
- Page 31
- Page 32
- Page 33
- Page 34
- Page 35
- Page 36
- Page 37
- Page 38
- Page 39
- Page 40
- Page 41
- Page 42
- Page 43
- Page 44
- Page 45
- Page 46
- Page 47
- Page 48
- Page 49
- Page 50
- Page 51
- Page 52
- Page 53
- Page 54
- Page 55
- Page 56
- Page 57
- Page 58
- Page 59
- Page 60
- Page 61
- Page 62
- Page 63
- Page 64
- Page 65
- Page 66
- Page 67
- Page 68
- Page 69
- Page 70
- Flash version
© UniFlip.com
Doku Onarımı 91
•
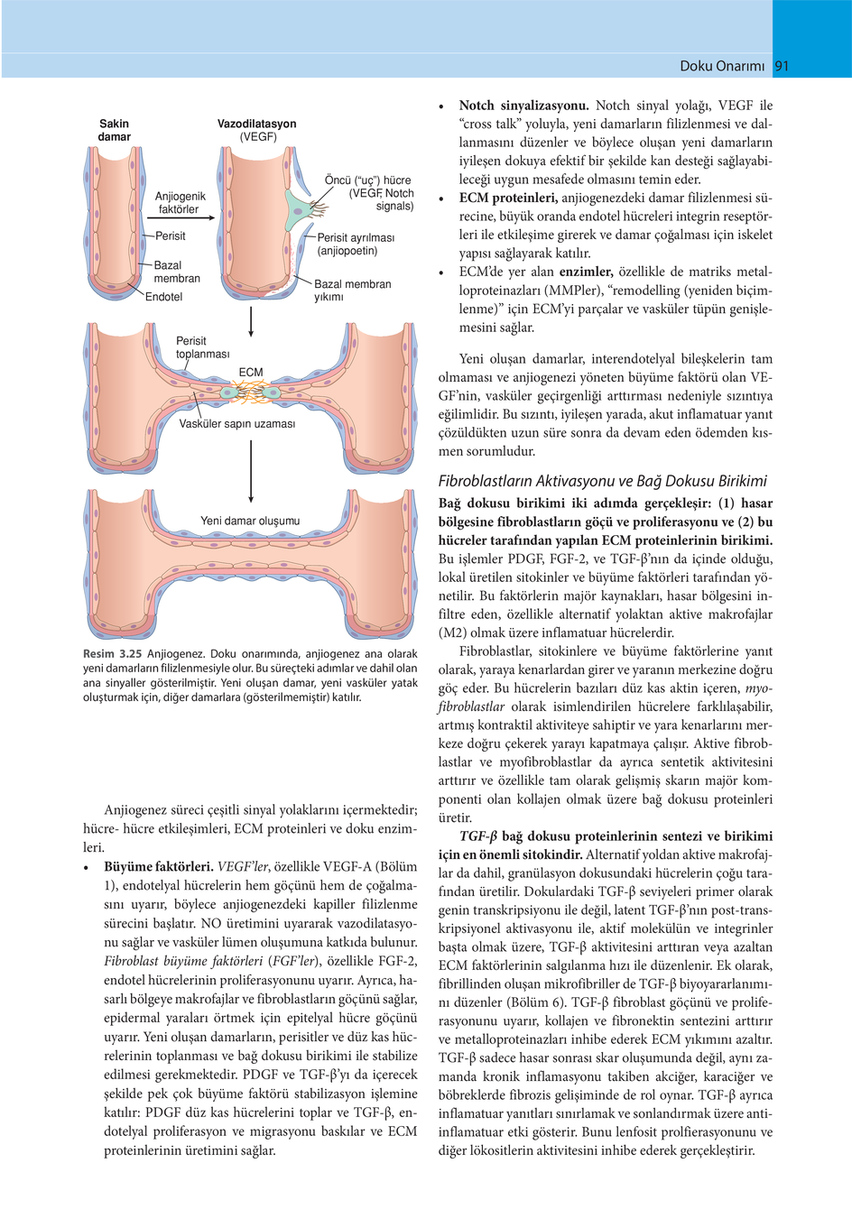
Sakin damar Vazodilatasyon (VEGF)
Anjiogenik faktörler Perisit Bazal membran Endotel
Öncü (“uç”) hücre (VEGF Notch , signals) Perisit ayrılması (anjiopoetin) Bazal membran yıkımı
•
•
Notch sinyalizasyonu. Notch sinyal yolağı, VEGF ile “cross talk” yoluyla, yeni damarların filizlenmesi ve dallanmasını düzenler ve böylece oluşan yeni damarların iyileşen dokuya efektif bir şekilde kan desteği sağlayabileceği uygun mesafede olmasını temin eder. ECM proteinleri, anjiogenezdeki damar filizlenmesi sürecine, büyük oranda endotel hücreleri integrin reseptörleri ile etkileşime girerek ve damar çoğalması için iskelet yapısı sağlayarak katılır. ECM’de yer alan enzimler, özellikle de matriks metalloproteinazları (MMPler), “remodelling (yeniden biçimlenme)” için ECM’yi parçalar ve vasküler tüpün genişlemesini sağlar.
Perisit toplanması ECM
Vasküler sapın uzaması
Yeni oluşan damarlar, interendotelyal bileşkelerin tam olmaması ve anjiogenezi yöneten büyüme faktörü olan VEGF’nin, vasküler geçirgenliği arttırması nedeniyle sızıntıya eğilimlidir. Bu sızıntı, iyileşen yarada, akut inflamatuar yanıt çözüldükten uzun süre sonra da devam eden ödemden kısmen sorumludur.
Fibroblastların Aktivasyonu ve Bağ Dokusu Birikimi
Yeni damar oluşumu
Resim 3.25 Anjiogenez. Doku onarımında, anjiogenez ana olarak yeni damarların filizlenmesiyle olur. Bu süreçteki adımlar ve dahil olan ana sinyaller gösterilmiştir. Yeni oluşan damar, yeni vasküler yatak oluşturmak için, diğer damarlara (gösterilmemiştir) katılır.
Anjiogenez süreci çeşitli sinyal yolaklarını içermektedir; hücre- hücre etkileşimleri, ECM proteinleri ve doku enzimleri. • Büyüme faktörleri. VEGF’ler, özellikle VEGF-A (Bölüm 1), endotelyal hücrelerin hem göçünü hem de çoğalmasını uyarır, böylece anjiogenezdeki kapiller filizlenme sürecini başlatır. NO üretimini uyararak vazodilatasyonu sağlar ve vasküler lümen oluşumuna katkıda bulunur. Fibroblast büyüme faktörleri (FGF’ler), özellikle FGF-2, endotel hücrelerinin proliferasyonunu uyarır. Ayrıca, hasarlı bölgeye makrofajlar ve fibroblastların göçünü sağlar, epidermal yaraları örtmek için epitelyal hücre göçünü uyarır. Yeni oluşan damarların, perisitler ve düz kas hücrelerinin toplanması ve bağ dokusu birikimi ile stabilize edilmesi gerekmektedir. PDGF ve TGF-β’yı da içerecek şekilde pek çok büyüme faktörü stabilizasyon işlemine katılır: PDGF düz kas hücrelerini toplar ve TGF-β, endotelyal proliferasyon ve migrasyonu baskılar ve ECM proteinlerinin üretimini sağlar.
Bağ dokusu birikimi iki adımda gerçekleşir: (1) hasar bölgesine fibroblastların göçü ve proliferasyonu ve (2) bu hücreler tarafından yapılan ECM proteinlerinin birikimi. Bu işlemler PDGF, FGF-2, ve TGF-β’nın da içinde olduğu, lokal üretilen sitokinler ve büyüme faktörleri tarafından yönetilir. Bu faktörlerin majör kaynakları, hasar bölgesini infiltre eden, özellikle alternatif yolaktan aktive makrofajlar (M2) olmak üzere inflamatuar hücrelerdir. Fibroblastlar, sitokinlere ve büyüme faktörlerine yanıt olarak, yaraya kenarlardan girer ve yaranın merkezine doğru göç eder. Bu hücrelerin bazıları düz kas aktin içeren, myofibroblastlar olarak isimlendirilen hücrelere farklılaşabilir, artmış kontraktil aktiviteye sahiptir ve yara kenarlarını merkeze doğru çekerek yarayı kapatmaya çalışır. Aktive fibroblastlar ve myofibroblastlar da ayrıca sentetik aktivitesini arttırır ve özellikle tam olarak gelişmiş skarın majör komponenti olan kollajen olmak üzere bağ dokusu proteinleri üretir. TGF-β bağ dokusu proteinlerinin sentezi ve birikimi için en önemli sitokindir. Alternatif yoldan aktive makrofajlar da dahil, granülasyon dokusundaki hücrelerin çoğu tarafından üretilir. Dokulardaki TGF-β seviyeleri primer olarak genin transkripsiyonu ile değil, latent TGF-β’nın post-transkripsiyonel aktivasyonu ile, aktif molekülün ve integrinler başta olmak üzere, TGF-β aktivitesini arttıran veya azaltan ECM faktörlerinin salgılanma hızı ile düzenlenir. Ek olarak, fibrillinden oluşan mikrofibriller de TGF-β biyoyararlanımını düzenler (Bölüm 6). TGF-β fibroblast göçünü ve proliferasyonunu uyarır, kollajen ve fibronektin sentezini arttırır ve metalloproteinazları inhibe ederek ECM yıkımını azaltır. TGF-β sadece hasar sonrası skar oluşumunda değil, aynı zamanda kronik inflamasyonu takiben akciğer, karaciğer ve böbreklerde fibrozis gelişiminde de rol oynar. TGF-β ayrıca inflamatuar yanıtları sınırlamak ve sonlandırmak üzere antiinflamatuar etki gösterir. Bunu lenfosit prolfierasyonunu ve diğer lökositlerin aktivitesini inhibe ederek gerçekleştirir.