¤> gibi) sikline ba¤>ml> kinaz> inhibe eden gen ürünleri gibi
(örn., p21)- y>pranm>fl hücrelerde afl>r> miktarda eksprese edi-
lir. Hücrelerin kendi bölünmelerini nas>l sayd>klar> yo¤un bir
araflt>rma konusudur. Bir muhtemel mekanizma fludur ki, her
bölünmede kromozom sonlar>n>n inkomplet replikasyonu
söz konusudur, bu da sonuçta hücre siklusunun durmas>y-
la son bulur. Telomerler kromozomlar>n sonlar>nda bulunan
tekrarlayan k>sa DNA sekanslar>d>r (TTAGGG). Bunlar kromo-
zom sonlar>n>n komplet replikasyonunu garantiye almak için
önemlidir. Kromozomal sonlanmalar>n füzyonunu ve degra-
dasyonunu önler.
k>sal>rken kromozomlar>n sonlar> korunamaz. Bu alanlar k>r>l-
m>fl DNA olarak hücre siklusunun durmas> için sinyal verir. Te-
lomerlerin uzunluklar> normalde telomeraz denen bir enzim
taraf>ndan yürütülen nükleotid eklenmesiyle korunur. Telome-
raz, nükleotidleri nükleozom sonlar>na eklemek için kendi
RNA's>n> bir taslak olarak kullanan özel bir RNA-protein komp-
leksidir (fiekil 1-45). Telomeraz aktivitesi telomer uzamas>n> s>-
n>rlayan ve böylece uzunluk duyarl> mekanizmay> oluflturan dü-
zenleyici proteinler taraf>ndan önlenir. Telomeraz aktivitesi
germ hücrelerinde vard>r ve düflük düzeylerde kök hücrelerde
de mevcuttur, fakat somatik hücrelerin ço¤unda genellikle bu-
lunmaz. Bundan dolay> hücreler yafllan>rken telomerleri k>sal>r
bunlar hücre siklusundan ç>karlar, sonuçta hasar görmüfl olan
hücrelerin yerini yeni hücrelerin almas>nda yetersizlik olur. Bu-
nun tersine ölümsüz kanser hücrelerinde telomeraz reaktive
edilir ve telomerler k>salmaz bu da kanser oluflumunda telomer
uzamas>n>n önemli belki de esas- aflama olabilece¤ini düflün-
dürmektedir.
le olan iliflkisi tam olarak ortaya konmay> beklemektedir.
iliflkilidir. Kalori al>m>n>n azalmas> veya reseptördeki mutas-
yonlar sonucunda IGF-1 reseptörü üzerinden sinyallerin azal-
mas> C. elegans'>n yaflam süresinin uzamas>yla sonuçlan>r. IGF-
1 reseptörleri boyunca giden sinyaller çok say>da kinaz> etkiler
ve belli genlerin susmas>na yol açbilir, böylece yafllanmay> ha-
rekete geçirir. Erken yafllanan insanlar>n incelenmesi ayn> fle-
kilde yafllanman>n rastgele bir süreç olmad>¤>n>, temel bir kav-
ram olarak spesifik genler, reseptörler ve sinyaller ile düzenle-
nen bir süreç oldu¤unu ortaya koymaktad>r.
hücre içerisinde meydana gelen metabolik olaylardan kaynak-
lanan hücre hasar> ve bu hasar> onaran moleküler yan>tlara ters
etki gösteren metabolik olaylar aras>ndaki denge taraf>ndan
belirlenir. Küçük hayvanlar, genellikle daha k>sa bir hayat sü-
resine ve daha h>zl> bir metabolizmaya sahiptir. Bu durum tür-
lerin yaflam sürelerinin bütün bir yaflam boyunca sabit olan to-
tal metabolik tüketim miktar> taraf>ndan s>n>rland>r>lm>fl oldu-
¤unu düflündürmektedir.
müz gibi oksidatif fosforilasyonun bu yan ürünleri proteinler,
lipidler ve nükleik asitlerin kovalent modifikasyonlar>na yol
açar. Organizma yaflland>kça artan oksidatif hasar>n miktar>
y>pranman>n önemli bir komponenti olabilir ve yafllanan hüc-
relerde lipofuskin birikimi böyle bir hasar>n önemli bir göster-
gesi olarak görülebilir. Böyle bir öneriyle uyumlu olacak afla¤>-
daki gözlemler yap>lm>flt>r; (1) farkl> türler aras>ndaki uzun ya-
flama varyasyonlar> süperoksit anyon radikalinin mitokondrial
oluflum h>z>yla ters orant>l>d>r; (2) antioksidan enzimler olan
süperoksit dismütaz (SOD) ve katalaz>n afl>r> miktarda ekspres-
yonu Droshophila'n>n transgenik formlar>nda yaflam süresini
uzat>r. Böylece yafllanman>n zaman>n> belirleyen mekanizma-
n>n bir k>sm> oksijen radikalleri gibi toksik metabolik yan ürün-
ler taraf>ndan oluflturulan kümülatif hasar olabilir. Artm>fl oksi-
datif hasar, iyonizan radyasyon, antioksidan savunma mekaniz-
malar>nda ilerleyici bozulma (örn., E vitamini, glutatyon pe-
roksidaz) ya da her ikisi gibi çevresel etkilere tekrar tekrar ma-
ruz kalmaktan kaynaklanabilir.
u¤ram>fl DNA'n>n tan>nmas> ve onar>m>d>r.
r>lmadan kal>r ve hücre yaflland>kça birikir. Çok say>da kan>t
yafllanma sürecinde DNA onar>m>n>n önemine vurgu yapmak-
tad>r. Werner sendromlu hastalar erken yafllanma gösterir, bu-
rada defektif gen ürünü, DNA replikasyonu ve onar>m> ile
DNA'n>n aç>l>m>nda gereken di¤er fonksiyonlara kat>lan bir
protein olan DNA helikazd>r.
kromozomal hasar>n h>zl> birikimine neden olur. Somatik hüc-
relerdeki genetik instabilite, ataksi-telenjiektazi gibi mutasyo-
na u¤ram>fl genin, DNA'daki çift sarmall> k>r>lmalar> onar>mda
görev alan bir proteini kodlad>¤>, hastalar>n artm>fl h>zda yafl-
lanma belirtileri gösterdi¤i di¤er hastal>klar>n da özelli¤idir
(Bölüm 7). C. elegans ve mutant maya mantarlar> üzerinde ya-
p>lan çal>flmalar e¤er DNA hasar>na yan>tlar h>zlanm>flsa, yaflam
sürecinin artt>¤>n> göstermektedir. Böylece kümülatif metabo-
lik hasar ve bu hasara karfl> geliflen yan>t aras>ndaki denge, yafl-
lanma h>z>m>z> belirler. Bu senaryoda, hasara karfl> gelifltirilen
yan>tlar art>r>larak ya da hasar birikimi azalt>larak yafllanma ge-
ciktirilebilir.
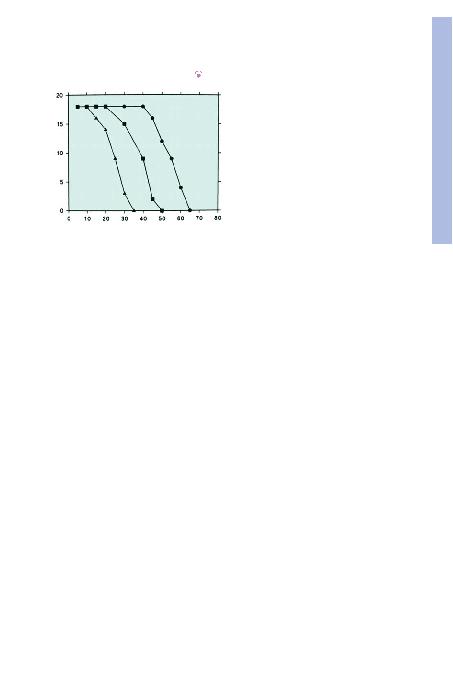
sendromu olan 20 yafl>ndaki bir hastadan izole edilen primer insan
fibroblastlar>n>n s>n>rl> popülasyon "doubling"leri. Hücrelerin bileflik
tek tabaka büyüme yetisi, populasyonun iki kat>na ç>kma ("doub-
ling") düzeyleri artt>kça azalmaktad>r (Pice JF: Cellular and molecu-
lar mechanisms of aging. Physiol Rev 73:150, 1993'den al>nm>flt>r).
Sendromu