al membranlarda ve sitoplazmada yerleflmifllerdir. Hücreler ya-
flamsal sinyallerden mahrum kald>klar>nda ya da strese maruz
kald>klar> zaman mitokondrial membrandan Bcl-2 ve/veya Bcl-
x kaybolur ve bunlar>n yerini ayn> protein ailesinden Bak, Bax,
ve Bim gibi proapoptotik bireyler al>r. Bcl-2/Bcl-x düzeyleri
azald>¤> zaman, mitokondrial membran>n geçirgenli¤i artar ve
kaspaz kaskad>n> aktive eden çeflitli proteinler d>flar> s>zar (fie-
kil 1-30). Bu proteinlerin biri, mitokondrial solunumda rolü
çok iyi bilinen, sitokrom-c'dir. Sitozolde, sitokromc Apaf-1 de-
nen proteine (C. elegans'daki Ced-4'ün homolog proteini,
apoptozu aktive eden faktör-1) ba¤lan>r, bu kompleks kaspaz-
9'u aktive eder (Bcl-2 ve Bcl-x ayn> zamanda direkt olarak Apaf-
1 aktivasyonunu inhibe edebilir, bunlar>n hücrelerden kaybol-
mas> Apaf-1'in aktivasyonuna izin verir).
57
Apoptoz indükleyici
faktör (AIF) gibi di¤er mitokondrial proteinler, normal fonksi-
yonlar> kaspaz aktivasyonunu bloke etmek olan çeflitli apoptoz
inhibitörlerini ba¤layacaklar> ve nötralize edecekleri yer olan si-
toplazmaya girerler.
58
Net olarak ortaya ç>kan sonuç ise kaspaz
kaskad>n>n bafllat>lmas>d>r. Buna göre, bu intrensek yola¤>n
esas> mitokondrial geçirgenli¤i düzenleyen pro-apoptotik
moleküller ile koruyucu moleküller aras>ndaki denge ve
normalde mitokondriler içinde sekestre edilen hücre ölümü
indükleyicilerinin serbest kalmas>d>r.
Apoptozun intrensek yolunun mitokondrilerin rolü olmak-
s>z>n tetiklenebildi¤ini gösteren oldukça çok say>da kan>t var-
d>r.
59
Apoptoz, mitokondrial kaspaz aktivasyonunun d>fl>nda
bir yol ile bafllat>labilir ve sonras>nda mitokondrial geçirgenli-
¤in art>fl> ve pro-apoptotik moleküllerin serbest kal>fl> ölüm sin-
yalini amplifiye eder.
46
Ancak mitokondriden ba¤>ms>z apopto-
zu bafllatan bu yolaklar iyice tan>mlanmam>flt>r. Apoptozu bafl-
latan intrensek ve ekstrensek yolaklar> ayr> ayr> anlatt>k, ancak
bunlar>n aras>nda örtüflmeler olabilir. Örne¤in, hepatositlerde,
Fas sinyali Bid denen, daha sonra mitokondrial yola¤> aktive
eden Bcl ailesinin bir pro-apoptotik üyesini aktive eder. Apop-
toz yolaklar> aras>ndaki buna benzer koopere etkileflimin di¤er
birçok hücre tiplerinde de olup olmad>¤> bilinmemektedir.
Uygulama Faz>. Apoptozun son faz>, çeflitli bafllat>c> me-
kanizmalar>n birleflti¤i bir proteolitik kaskad arac>l>¤> ile yürü-
tülür. Bitirme faz>n> yürüten proteazlar türlerde çok iyi korun-
mufltur ve daha önce de bahsedildi¤i gibi kaspaz ailesine aittir.
Bunlar C. elegans'daki ced-3 geninin memelilerdeki homolog-
lar>d>r.
44
"Caspase" terimi, bu enzim ailesinin iki özelli¤i üzeri-
ne kurulmufltur: "c", cystein proteaza (aktif bölgesinde sistein
bulunan bir enzim), "aspase" da bu enzimlere özgü olan aspar-
tik asit rezidülerinden sonra k>rma yetene¤ine gönderme yap-
maktad>r.
60
fiimdi 10 dan fazla üyesi olan kaspaz ailesi, apop-
toz s>ras>nda aktive olduklar> s>raya göre fonksiyonel olarak iki
temel gruba -bafllat>c> ve uygulay>c>- ayr>l>rlar.
60
Gördü¤ümüz
KISIM I
Genel Patoloji
30
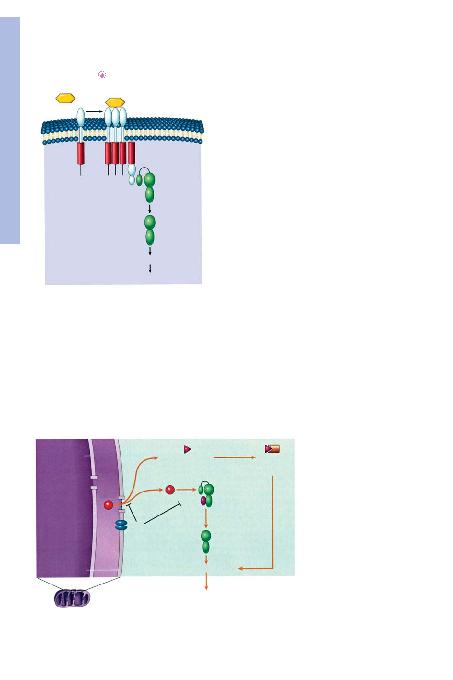
fiEKApoptozun, Fas ba¤lanmas>n> izleyen olaylar>n gösterildi-
¤i ekstrensek (ölüm reseptörünün-bafllatt>¤>) yola¤> (metne bak>n>z).
fiEKApoptozun intrensek (mi-
tokondrial) yola¤>. Ölüm agonistleri mi-
tokondri iç membran>nda mitokondri-
al geçirgenlik geçifl yerinde (MGG)
kaspazlar> aktive eden sitokrom c ve
di¤er pro-apoptotik proteinlerin sito-
zol içine sal>nmas> ile sonuçlanan de¤i-
flikli¤e neden olurlar (metne bak>n>z).
FasL
Ölüm
bölgesi
FADD
Fas
Pro-kaspaz-8
Uygulay>c> kaspazlar
APOPTOZ
Aktif
Kaspaz-8
<ç membran
D>fl membran
Sitokrom c
Sitokrom c
Apaf-1
Bcl-2
S
Di¤er pro-apoptotik
proteinler (örn., AIF)
Aktif
Kaspaz-9
Pro
Kaspaz-9
Kaspaz
aktivasyonu
Apoptoz
inhibitörleri
(IAP
s
)
Ba¤lanma ve
nötralizasyon
Uygulay>c> kaspazlar
APOPTOZ
MGG (MPT)
Otokatalitik
kaspaz
aktivasyonu
