edilir.
78
fiaperonlar uygun katlanmaya ve ER, Golgi komp-
leksi boyunca ve onlar>n ötesine transporta yard>mc> olur-
lar (fiekil 1-39). Baz> flaperonlar elementer olarak sentezle-
nir ve normal intraselüler protein trafi¤ini etkilerken di-
¤erleri s>cak gibi streslerle indüklenir (örn., >s>-flok prote-
inleri, hsp 70, hsp 90) ve flok-stresli proteinleri yanl>fl kat-
lanmas>ndan "korurlar". E¤er katlanma süreci baflar>l> de-
¤ilse, flaperonlar hasar görmüfl proteinlerin degradasyonu-
nu kolaylaflt>r>r. Bu degradasyon süreci, anormal pro-
teinlere eklenerek proteozom kompleksi taraf>ndan degra-
dasyonu için iflaretleyen ubikuitini (o da bir >s>-flok prote-
inidir) iflin içine katar. bilen veya hastal>¤a yol açabilen protein katlanma defekt-
leri için çeflitli mekanizmalar bulunmaktad>r.
· Kritik proteinlerin defektif intraselüler transportu
ve sal>n>m>.
1
antitripsin eksikli¤inde, proteindeki
mutasyonlar yap>lanmay> belirgin flekilde yavafllat>r, ka-
raci¤er ER'unda biriken ve sekrete edilmeyen k>smen
katlanm>fl ara ürün protein oluflmas>na yol açar. Sonuç-
ta ortaya ç>kan dolafl>mdaki enzim yetmezli¤i amfizeme
neden olur (Bölüm 15). Kistik fibrozisde, mutasyon,
anormal katlanma ve fonksiyon kayb>na yol açan bir klo-
rid kanal> proteininin flaperonlar>ndan birinden ayr>lma-
s>nda gecikme olur (Bölüm 10). Familiyal hiperkoleste-
rolemide düflük-dansiteli lipoprotein reseptörlerindeki
mutasyonlar reseptör proteinlerinin uygun katlanmas>-
na engel olur (Bölüm 5).
· Katlanmam>fl ya da yanl>fl katlanm>fl proteinler ta-
raf>ndan indüklenen ER stresi. Katlanmam>fl ya da yan-
l>fl katlanm>fl proteinler ER de birikir ve çok say>da hüc-
resel yan>t> tetikler. Hepsine birden katlanmam>fl prote-
in yan>t> denir.
79-81
Katlanmam>fl protein yan>t> ER mem-
bran aral>¤>nda yerleflen çeflitli proteinler taraf>ndan yü-
rütülür. Bu proteinlerin lüminal bölgeleri protein katlan-
mas>ndaki dalgalanmalara duyarl>d>r ve sitoplazmik böl-
geler, hücre içindeki yanl>fl katlanm>fl protein düzeyini
azaltan sinyal yola¤>n> harekete geçirir. Bunu flaperon
üretimini art>rarak ve protein translasyonunu yavafllata-
rak yapar. Paradoksal olarak katlanmam>fl protein yan>t>
kaspazlar>, özellikle kaspaz 12 denen bir ER-yerleflimli
kaspaz> aktive ederek hücre ölümüne yol açar. Böylece
yanl>fl katlanm>fl proteinler bafllang>çta bu yan>t>n hücre
koruyucu fonksiyonunu tetikler, fakat bu anormal prote-
inlerin varl>¤> devam ederse pro-apoptotik sitotoksik
fonksiyonlar harekete geçer. Günümüzde genetik mutas-
yonlar, yafllanma veya nedeni bilinmeyen çevresel faktör-
ler nedeniyle ortaya ç>kan anormal katlanm>fl proteinlerin
birikimi, aralar>nda Alzheimer hastal>¤>, Hungtington has-
tal>¤> ve Parkinson hastal>¤> bulunan (Bölüm 28) çok say>-
da nörodejeneratif hastal>¤>n ve muhtemelen tip II diya-
betin bir özelli¤i olarak kabul edilmektedir. Glukoz ve ok-
sijen eksikli¤i ile >s> gibi bir stres, proteinlerin yanl>fl kat-
lanmas>na yol açar ve hücre zedelenmesi ve ölüm ile so-
nuçlanan katlanmam>fl protein yan>t>n> tetikler.
KISIM I
Genel Patoloji
38
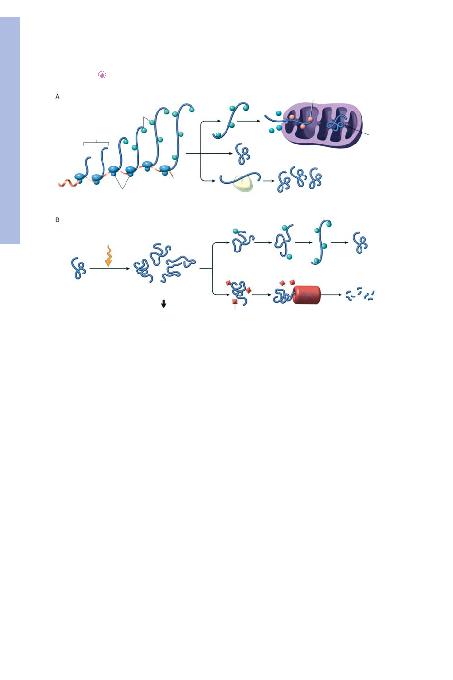
fiEKProtein katlanma mekanizmalar> ve flaperonlar>n rolü. A, Is> flok proteinleri ("heat shock protein" [HSP]) gibi flaperonlar katlanma-
m>fl veya k>smen katlanm>fl proteinleri y>k>mdan korur ve proteinleri organellerin içine yöneltir. B, fiaperonlar yanl>fl katlanm>fl proteinleri ona-
r>r; bu aflama etkili olmazsa, proteinler degradasyon (y>k>m) için proteazom içine yönlendirilir ve e¤er yanl>fl katlanm>fl proteinler birikirse, apop-
tozu tetikler.
PROTE
PROTE
STRES
(UV, s>cakl>k, serbest radikal zedelenmesi, vb.)
Protein
Fonksiyonel olmayan
proteinler ve birikimler
HÜCRE ÖLÜMÜ
Ubikuitin
Proteazom
Çözülmüfl peptid
fragmanlar>
fiaperon (örn.,
Hsp)
Sekonder flaperon
Matür katlanm>fl proteinler
Matür
katlanm>fl
mitokondrial
protein
Matür katlanm>fl protein
Mitokondrial flaperon (örn.,
Hsp 60)
fiaperon
(örn.,
Hsp 60)
Olgunlaflmam>fl
peptid
mRNA
Ribozomlar
