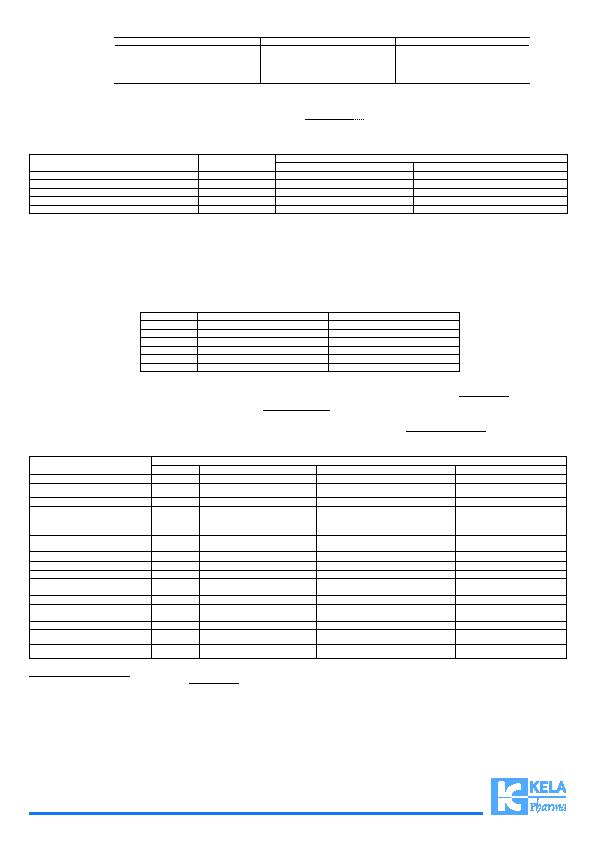
Insuffi sance rénale légère
Insuffi sance rénale modérée
Insuffi sance rénale sévère
Insuffi sance rénale terminale sous dialyse (1)
30-49
500 à 1.000mg 2 fois par jour
250 à 500mg 2 fois par jour
lévétiracétam doit être ajustée selon la fonction rénale car la clairance du lévétiracétam est dépendante de celle-ci. Cette recommandation se base sur une étude chez l'adulte insuffi sant rénal. La CL
50kg atteint d'insuffi sance rénale:
traitement par lévétiracétam. (3) Une dose de charge de 15mg/kg (0,15ml/kg) est recommandée le premier jour de traitement par lévétiracétam. (4) Après dialyse, une dose supplémentaire de 3,5 à 7mg/kg (0,035 à 0,07ml/kg) est recommandée.
(5) Après dialyse, une dose supplémentaire de 5 à 10mg/kg (0,05 à 0,10ml/kg) est recommandée. Insuffi sance hépatique: Aucun ajustement de la dose n'est nécessaire chez le patient atteint d'insuffi sance hépatique légère à modérée. Chez le
patient atteint d'insuffi sance hépatique sévère, l'évaluation de la clairance de créatinine peut faire sous-estimer l'insuffi sance rénale. Par conséquent, une réduction de 50% de la dose quotidienne d'entretien est recommandée en cas de clairance
de la créatinine < 60ml/min/1,73 m
traitement initial des enfants pesant moins de 25kg, aux patients ne pouvant pas avaler de comprimés ou à l'administration de doses inférieures à 250mg. Dans tous ces cas, Lévétiracétam solution buvable doit être utilisée. En monothérapie:
La sécurité et l'effi cacité de lévétiracétam chez l'enfant et l'adolescent de moins de 16 ans n'ont pas été établies en monothérapie. Il n'y a pas de données disponible. Traitement en association chez le nourrisson de 6 à 23 mois, l'enfant (2 à 11
ans) et l'adolescent (12 à 17 ans) pesant moins de 50kg: Lévétiracétam solution buvable est la forme à utiliser de préférence chez les nourrissons et les enfants de moins de 6 ans. La dose thérapeutique initiale est de 10mg/kg 2 fois par jour.
En fonction de la réponse clinique et de la tolérance, la dose peut être augmentée jusqu'à 30mg/kg 2 fois par jour. Les augmentations et diminutions de doses ne devraient pas dépasser 10mg/kg 2 fois par jour toutes les 2 semaines. La dose
minimale effi cace doit être utilisée. La posologie chez l'enfant de 50kg ou plus est la même que chez l'adulte. Recommandations posologiques chez le nourrisson à partir de 6 mois, l'enfant et l'adolescent:
chez le nourrisson âgé de 1 mois à moins de 6 mois: Le comprimé n'est pas adapté au traitement chez l'enfant âgé moins de 6 mois. La solution buvable est la forme à utiliser chez le nourrisson. Mode d'administration: Les comprimés pelliculés
doivent être pris oralement avec une quantité suffi sante de liquide et peuvent être pris au cours ou en dehors des repas. La posologie quotidienne se fait en deux prises égales. Contre-indications: Hypersensibilité au substance actif ou aux
autres dérivés de la pyrrolidone, ou à l'un des excipients mentionnés à la rubrique 6.1. Effets indésirables: Résumé du profi l de tolérance: Le profi l des événements indésirables présenté ci-dessous est basé sur l'analyse de l'ensemble des essais
cliniques contrôlés versus placebo réalisés dans toutes les indications, soit un total de 3.416 patients traités par lévétiracétam. Ces données sont complétées par celles de l'utilisation du lévétiracétam dans les études correspondantes de suivi
en ouvert, ainsi que par celles issues de la surveillance après commercialisation. Les effets indésirables les plus fréquemment rapportés ont été: rhinopharyngite, somnolence, céphalée, fatigue et sensation vertigineuse. Le profi l de tolérance du
lévétiracétam est généralement similaire au sein des différentes classes d'âge (adultes et patients pédiatriques) et pour toutes les indications approuvées dans l'épilepsie. Liste tabulée des effets indésirables: Les effets indésirables rapportés au
cours des études cliniques (adulte, adolescent, enfant et nourrisson de plus de 1 mois) et depuis la commercialisation sont présentés par classe-organe et par fréquence, dans le tableau ci-dessous. La fréquence est défi nie de la façon suivante:
très fréquent (
lymphatique
d'administration
procédures
aplasie médullaire a été identifi ée dans quelques cas de pancytopénie. Population pédiatrique: Chez les patients âgés de 1 mois à moins de 4 ans, un total de 190 patients a été traité par le lévétiracétam au cours d'études contrôlées versus
placebo et d'études de suivi en ouvert. Soixante (60) de ces patients ont été traités par le lévétiracétam au cours d'études contrôlées versus placebo. Chez les patients âgés de 4 à 16 ans, un total de 645 patients a été traité par le lévétiracétam
au cours d'études contrôlées versus placebo et d'études de suivi en ouvert. 233 de ces patients ont été traités par le lévétiracétam au cours des études contrôlées versus placebo. Les données au sein de ces deux tranches d'âges pédiatriques
sont complétées par la surveillance de l'utilisation du lévétiracétam après commercialisation. Le profi l de tolérance du lévétiracétam est généralement similaire au sein des différentes tranches d'âge et dans toutes les indications approuvées
dans l'épilepsie. Les résultats de tolérance des patients pédiatriques suivis dans les études cliniques contrôlées versus placebo sont comparables au profi l de tolérance du lévétiracétam chez les adultes, à l'exception des effets indésirables
comportementaux et psychiatriques qui sont plus fréquents chez les enfants que chez les adultes. Chez les enfants et les adolescents âgés de 4 à 16 ans, les vomissements (très fréquents, 11,2%), l'agitation (fréquent, 3,4%), les sautes d'humeur
(fréquent, 2,1%), la labilité émotionnelle (fréquent, 1,7%), l'agressivité (fréquent, 8,2%), le comportement anormal (fréquent, 5,6%) et la léthargie (fréquent, 3,9%) ont été rapportés plus fréquemment que dans les autres classes d'âge ou que
dans le profi l de tolérance général. Chez les nourrissons et les enfants âgés de 1 mois à moins de 4 ans, l'irritabilité (très fréquent, 11,7%) et le trouble de la coordination (fréquent, 3,3%) ont été rapportés plus fréquemment que dans les autres
classes d'âge ou que dans le profi l de tolérance général. Une étude de tolérance «non-infériorité» dans la population pédiatrique, en double aveugle, contrôlée versus placebo, a permis d'évaluer les effets cognitifs et neuropsychologiques de
lévétiracétam chez les enfants de 4 à 16 ans ayant des crises partielles. Il a été conclu que lévétiracétam n'était pas différent («non inférieur») du placebo pour la modifi cation du score Leiter-R Attention and Memory, Memory Screen Composite
dans la population per protocole par rapport au score à l'inclusion. Les résultats concernant les fonctions comportementale et émotionnelle ont indiqué une aggravation du comportement agressif chez les patients traités par lévétiracétam, selon
une mesure standardisée et systématique utilisant un instrument validé (Child Behavior Checklist d'Achenbach - CBCL). Cependant, les sujets traités par lévétiracétam dans l'étude de suivi à long terme en ouvert n'ont pas présenté, en moyenne,
d'altération des fonctions comportementale et émotionnelle, en particulier, les mesures du comportement agressif n'ont pas montré d'aggravation par rapport aux valeurs à l'inclusion.
BE416315 BE416324.