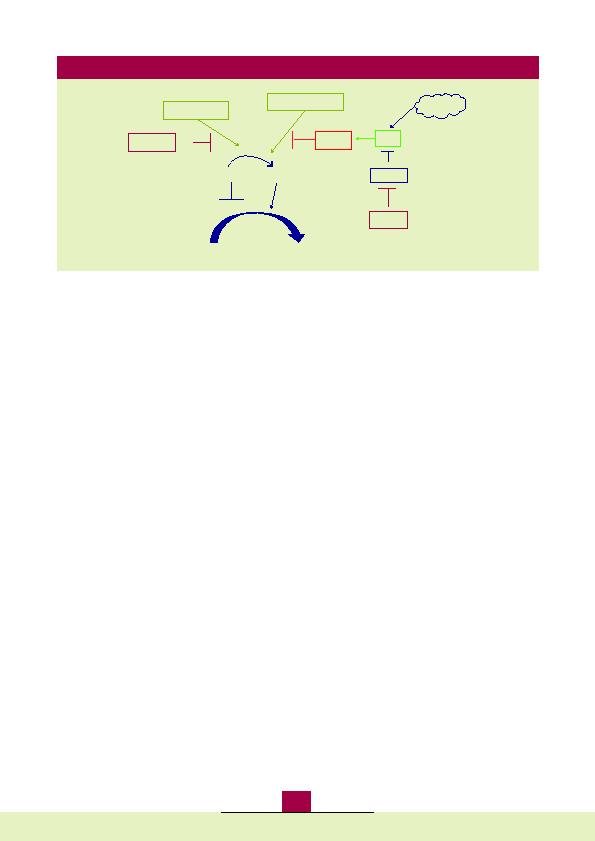
de Rb1, tandis que des taux faibles stimulent la prolifération
cellulaire (6). Ainsi, toute altération du gène CDKN2A codant
pour p16
d'autres molécules impliquées dans cette voie de contrôle du
cycle cellulaire sont moins fréquemment altérées.
Des mutations germinales de CDK4, rapportées dans une
faible proportion de mélanomes familiaux, empêchent la liaison
du complexe CCND1/CDK4 à p16
par phosphorylation de Rb1. Des mutations de p16
Ces mutations sont le plus souvent exclusives et rencontrées
séparément.
Une amplification de CDK4 peut être retrouvée dans les méla-
nomes sporadiques muqueux ou de la zone acrale.
Les mutations inactivant Rb1 sont rarement détectées dans les
mélanomes sporadiques, tandis qu'elles peuvent être présentes
dans les mélanomes familiaux (6).
dans l'inhibition du cycle cellulaire et dans l'apoptose. L'activité
de p53 est sous le contrôle de MDM2, responsable de sa dé-
gradation. MDM2 est à son tour régulé par p14
En cas d'altération de l'ADN, p53 induit l'expression de p21,
qui inhibe le complexe cyclin E et CDK2 (CCNE1/CDK2),
conduisant à une réduction de la phosphorylation de Rb1 blo-
quant la transition G1/S du cycle cellulaire (6).
Cependant, les mélanomes présentent peu de mutations de
p53 par rapport aux autres cancers, indiquant par là que les
de p14
le mélanome
à l'expression de signaux anti-apoptotiques, à l'activation par
des facteurs de croissance, à la perturbation de la régulation de
la différenciation cellulaire, à des modifications de l'adhésion et
à l'acquisition de capacités de migration cellulaire.
nome est la voie Mitogen Activated Protein Kinase (MAPK ou
RAS/BRAF/MEK/ERK), qui induit des facteurs de transcription
de gènes intervenant dans la croissance et la différenciation
cellulaires. Cette cascade est initiée par un récepteur membra-
naire à activité tyrosine kinase (RTK) activé par divers facteurs
de croissance; cette activation induit, via une protéine-G effec-
trice RAS dont il existe plusieurs isoformes (HRAS, KRAS,
NRAS), la phosphorylation en cascade de molécules succes-
sives, dont (B)RAF, MEK (MAP2K, MAPK/ERK kinase) et enfin
Extracellular signal-Regulated protein Kinase (ERK/MAPK3 et
MAPK1) (6, 7).
L'activation de ERK induit l'activation du CCND-CDK4/6
(13), l'activité mitotique et inhibe l'apoptose. En conditions
physiologiques, cette voie est peu activée et hautement
contrôlée (6).
Des altérations aboutissant à la phosphorylation et à l'activa-
tion de MAPK sont décrites dans 90% des mélanomes (6).
Des mutations activatrices des gènes BRAF et NRAS sont dé-
crites dans le mélanome (6, 14). Celles de BRAF sont associées