Skin
Vol 16
N°1
2013
36
térature anglophone. L'âge moyen de pré-
sentation est 65 ans. Le pouce est le plus
fréquemment touché, suivi par l'hallux et
le majeur droit. Le délai diagnostique est
variable (de 8 mois à 40 ans), en moyenne
une dizaine d'années. L'image clinique est
extrêmement variée et évoque une paro-
nychie chronique, un granulome pyogé-
nique, un mélanome achromique, une
infection bactérienne, une infection my-
cosique, un traumatisme, une maladie de
Bowen ou une mélanonychie longitudinale.
La présentation classique du carcinome ba-
socellulaire avec des nodules aux bordures
perlées ou une friabilité n'était visible que
dans une minorité de cas. Dans la plupart
des cas, l'option thérapeutique choisie
était la chirurgie de Mohs, avec d'excel-
lents résultats. D'autres cas ont fait l'objet
d'excision et/ou d'amputation (28).
LE CARCINOME VERRUQUEUX
Seuls 11 cas ont été décrits dans la lit-
térature. Il s'agit d'un carcinome épider-
moïde de bas grade à agressivité locale
et faible potentiel métastatique.
L'image
clinique est souvent évocatrice: une
lésion verruqueuse, en forme de chou-
fleur. La chirurgie de Mohs est le traite-
ment de choix mais dans les cas avancés,
l'amputation peut être nécessaire. Une
perfusion intra-artérielle de métho-
trexate a également été tentée (29).
AUTRES TUMEURS MALIGNES
EXCEPTIONNELLES
Quelques cas anecdotiques de gloman-
giosarcome, carcinome de Merkel, léio-
myosarcome et liposarcome de l'appareil
unguéal ont été décrits. Leur rareté induit
systématiquement un délai diagnostique
important (30).
CONCLUSION
La reconnaissance des tumeurs malignes
de l'appareil unguéal est difficile, même
pour un oeil averti. Heureusement la
majorité d'entre elles ont un faible poten-
tiel métastatique, sauf pour le mélanome,
dont le diagnostic encore trop souvent
tardif met en jeu le pronostic vital du pa-
tient. Il ne faut donc en aucun cas hésiter
à pratiquer une biopsie d'une lésion aty-
pique ou traînante, puisque le pronostic
de toutes ces tumeurs reste excellent pour
autant que le diagnostic soit précoce.
* La chirurgie de Mohs «originale», appelée éga-
lement chirurgie micrographique, excise la lésion
tumorale en bloc jusqu'à l'hypoderme, la découpe en
quatre quartiers qui sont chacun encrés d'une couleur
différente. Ces blocs orientés sont congelés et débités
horizontalement au cryostat. En présence des marges
envahies, le chirurgien reprend à nouveau la zone
parfaitement identifiée par l'orientation, et ce jusqu'à
obtention de marges saines.
Références
1.
Mikhail GR. Subungual epidermoid carcinoma. J Am Acad
Dermatol 1984;11:291-8.
2.
Koch A, Schönlebe J, Haroske G, et al. Polydactylous Bowen's
disease. J Eur Acad Dermatol Venereol 2003;17(2):213-5.
3.
Riddel C, Rashid R, Thomas V. Ungual and periungual human
papillomavirus-associated squamous cell carcinoma: a review.
J Am Acad Dermatol 2011;64(6):1147-53.
4.
Theunis A, André J, Noël JC. Evaluation of the role of genital
human papillomavirus in the pathogenesis of ungual squamous
cell carcinoma. Dermatology 1999;198(2):206-8.
5.
Kaiser JF, Proctor-Shipman L. Squamous cell carcinoma in situ
(Bowen's disease) mimicking subungual verruca vulgaris. J Fam
Pract 1994;39(4):384-7.
6.
Baran R, Eichmann A. Longitudinal melanonychia associated
with Bowen's disease: two new cases. Dermatology
1993;186(2):159-60.
7.
Baran R, Perrin C. Pseudo-fibrokeratoma of the nail apparatus
with melanocytic pigmentation: a clue for diagnosing Bowen's
disease. Acta Derm Venereol 1994;74(6):449-50.
8.
Baran R, Perrin C. Bowen's disease clinically simulating an
onychomatricoma. J Am Acad Dermatol 2002;47(6):947-9.
9.
Cogrel O, Beylot-Barry M, Doutre MS. Subungual squamous
cell carcinoma revealed by longitudinal erythronychia. Ann
Dermatol Venereol 2008;135(12):883-5.
10. Ongenae K, Van De Kerckhove M, Naeyaert JM. Bowen's
disease of the nail. Dermatology 2002;204(4):348-50.
11. Richert B, Di Chiacchio N, Haneke E. Nail Surgery. Informa
Healthcare 2010:74.
12. Dalle S, Depape L, Phan A, et al. Squamous cell carcinoma of
the nail apparatus: clinicopathological study of 35 cases. Br J
Dermatol 2007;156(5):871-4.
13. Alam M, Caldwell JB, Eliezri YD. Human papillomavirus-
associated digital squamous cell carcinoma: literature
review and report of 21 new cases. J Am Acad Dermatol
2003;48(3):385-93.
14. Martin DE, English JC, Goitz RJ. Subungual malignant
melanoma. J Hand Surg Am 2011;36(4):704-7.
15. Tosti A, Piraccini BM, de Farias DC. Dealing with melanonychia.
Semin Cutan Med Surg 2009;28(1):49-54.
16. Tosti A, Piraccini BM, Cagalli A, Haneke E. In Situ Melanoma of
the Nail Unit in Children: Report of Two Cases in Fair-Skinned
Caucasian Children. Pediatr Dermatol 2011, 1-5.
17. Koga H, Saida T, Uhara H. Key point in dermoscopic
differentiation between early nail apparatus melanoma and
benign longitudinal melanonychia. J Dermatol 2011;38(1):45-52.
18. Tan KB, Moncrieff M, Thompson JF, et al. Subungual
melanoma: a study of 124 cases highlighting features of early
lesions, potential pitfalls in diagnosis, and guidelines for
histologic reporting. Am J Surg Pathol 2007;31(12):1902-12.
19. Stern DK, Creasey AA, Quijije J et al. UV-A and UV-B
penetration of normal human cadaveric fingernail plate. Arch
Dermatol. 2011; 147(4):439-41.
20. Möhrle M, Häfner HM. Is subungual melanoma related to
trauma? Dermatology 2002;204(4):259-61.
21. Levit EK, Kagen MH, Scher RK, et al. The ABC rule for clinical
detection of subungual melanoma. J Am Acad Dermatol
2000;42(2 Pt 1):269-74.
22. Jellinek N. Nail matrix biopsy of longitudinal melanonychia:
diagnostic algorithm including the matrix shave biopsy. J Am
Acad Dermatol 2007;56(5):803-10.
23. André J, Moulonguet I, Goettmann-Bonvallot S. In situ
amelanotic melanoma of the nail unit mimicking lichen planus:
report of 3 cases. Arch Dermatol 2010;146(4):418-21.
24. Thai KE, Young R, Sinclair RD. Nail apparatus melanoma.
Australas J Dermatol 2001;42(2):71-81; quiz 82-3.
25. Braun RP, Baran R, Le Gal FA, et al. Diagnosis and management
of nail pigmentations. J Am Acad Dermatol 2007;56(5):835-47.
26. Moehrle M, Metzger S, Schippert W, et al. «Functional» surgery
in subungual melanoma. Dermatol Surg 2003;29(4):366-74.
27. Sureda N, Phan A, Poulalhon N, et al. Conservative surgical
management of subungual (matrix derived) melanoma:
report of seven cases and literature review. Br J Dermatol
2011;165(4):852-8.
28. Bandyopadhyay D, Sen S. Periungual Basal cell carcinoma:
a case report with review of literature. Indian J Dermatol
2011;56(2):220-2.
29. Sheen MC, Sheen YS, Sheu HM, et al. Subungual verrucous
carcinoma of the thumb treated by intra-arterial infusion with
methotrexate. Dermatol Surg 2005;31:787-9.
30. Jellinek NJ. Advances in Dermatology, Mosby, 2005;(21):56.
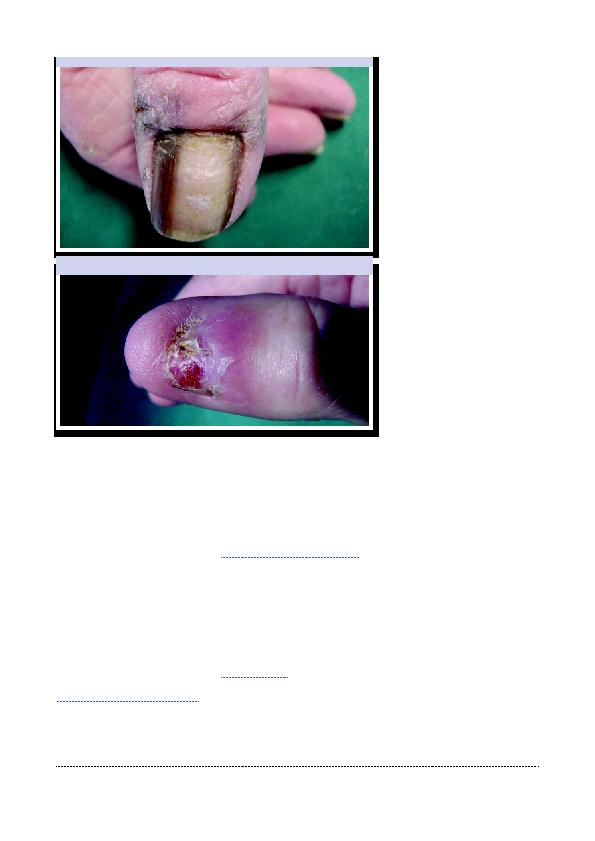
Figure 5: Mélanome unguéal matriciel. Notez le débordement pigmentaire.
Figure 6: Mélanome amélanotique. L'absence d'ongle fait suite à une chirurgie pour une
dystrophie unguéale. Il devait déjà s'agir d'un mélanome débutant...
