la phosphodiestérase-4) a été évaluée chez des pa-
tients ayant un syndrome de Behçet avec au moins
2 ulcères actifs de la cavité orale dans le cadre d'une
étude de phase II, multicentrique, randomisée,
contrôlée versus placebo.
Les patients ont été randomisés vers un bras apremilast
(APR) 30mg x 2/j ou placebo pendant 12 semaines puis
tous les patients restants ont reçu l'APR pendant 12 se
maines. Tous les patients randomisés ont été suivis pen
dant 28 jours après l'arrêt de leur traitement quel que soit
le moment et la raison de l'interruption.
Le critère principal d'évaluation était le nombre d'ulcères
oraux actifs à la fin de la semaine 12. Le nombre d'ulcères
génitaux à la semaine 12, l'efficacité thérapeutique au fil du
temps (aire sous la courbe pour les ulcères oraux et géni
taux les 12 premières semaines), l'activité de la maladie,
les données rapportées par les patients et les événements
indésirables constituaient les critères secondaires. Au total
111 patients (âge moyen 34,5 ± 10,1 ans, 69 % de femmes)
ont été randomisés (APR 55, placebo 56) et 95 ont terminé
la première phase de traitement (APR 50, placebo 45).
0,5 ± 1,03 dans le bras APR et de 2,1 ± 2,58 dans le bras
placebo (p <0,0001).
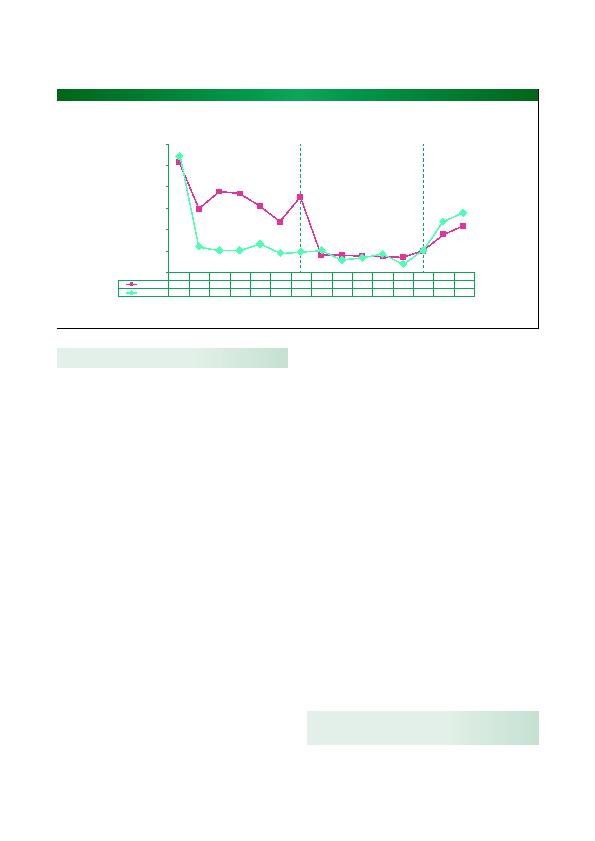
La figure 2 montre l'évolution temporelle du nombre
moyen d'ulcères oraux. On peut constater que l'effet béné
fique de l'APR s'exerce très rapidement (dès la semaine 2)
et se maintient tant que les sujets reçoivent l'APR, mais
disparaît peu de temps après l'arrêt à la semaine 24.
réponse complète (absence d'ulcères oraux) était signifi
cativement plus élevé dans le bras APR que dans le bras
placebo, respectivement 71% versus 29%, p < 0,0001).
A l'inclusion, 16 patients avaient des ulcères génitaux (bras
APR 10 et bras placebo 6). La totalité des 10 patients du
bras APR présentait une réponse complète à la semaine 12
versus 3 des 6 patients du bras placebo (p = 0,036).
Les changements moyens des différents scores utilisés
pour apprécier l'activité de la maladie, l'intensité des
douleurs liées aux ulcères et la qualité de vie étaient tous
significativement en faveur de l'APR.
Deux événements indésirables graves ont été documentés
dans le bras APR (une diplégie et une fissure anale plus
hémorroïdes ) et 3 dans le bras placebo (2 flambées de la
maladie et un épisode fébrile). La diplégie a été transitoire
et n'a pas été considéré comme liée à l'APR.
acceptable les lésions cutanéomuqueuses orales et géni
tales du syndrome de Behçet, manifestations typiques qui
résistent fréquemment aux traitements classiques et sont
souvent invalidantes.
Et canakinumab
études de phase 3 et l'analyse des changements du
profil d'expression génique et des taux sanguins
AS