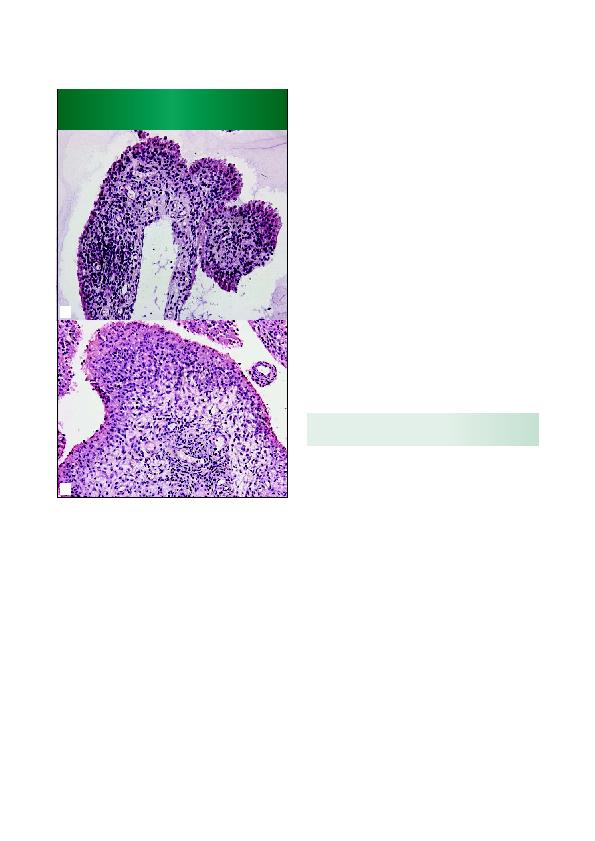
een hoog debiet uitgevoerd bij patiŽnten met diverse in-
flammatoire aandoeningen (1). Met de microchips die er
worden gebruikt, kan men we de expressie van 50.000
verschillende boodschapper-RNA's (transcripten) in een
gegeven monster tegelijkertijd analyseren. Daarna gaan
we na hoe de RNA's die sterk tot expressie worden ge-
bracht in een biopt, binnen een gegeven pathogenetisch
proces of een satellietproces vallen en proberen we zo om
een "moleculaire handtekening" te identificeren die eigen
is aan het monster.
stemt meestal overeen met een activering van T- en B-
lymfocyten. Die handtekening vinden we ook terug bij
lupusartritis, maar in dat geval in combinatie met een
sterke interferonhandtekening (overexpressie van genen
die worden geÔnduceerd door type I-interferon). Bij spon-
dylartropathie en meer nog bij artrose vinden we vooral
een handtekening van activering van fibroblasten (die
handtekening is ook aanwezig, maar in mindere mate,
variaties naargelang de patiŽnt. Zo hebben we recente-
lijk vastgesteld dat de activiteit van de ziekte (die typisch
lager is bij beginnende of ongedifferentieerde artritis)
een sterke invloed heeft op de mate van expressie van de
genen. Wij vinden die moleculaire profielen echter vol-
doende specifiek om te onderzoeken of ze van nut zouden
kunnen zijn bij de diagnostiek van patiŽnten met ongedif-
ferentieerde artritis. Een BioWin-project heeft zo geleid
tot de ontwikkeling van de RheumaKit (www.rheumakit.
com), een microchip met lage dichtheid die in combinatie
met enkele geselecteerde klinische parameters een vroege
diagnose geeft bij meer dan 90% van de patiŽnten met
een ongedifferentieerde artritis.
vooral diagnostische waarde heeft in het kader van de kli-
nische taxonomie van reumatische aandoeningen dan wel
of die informatie, zoals we later nog zullen aantonen, ook
een specifiek idee geeft van de ernst van de aandoening en
de mogelijke respons op de behandeling bij een gegeven
patiŽnt. Die informatie is minstens even relevant als, of
zelfs relevanter dan een diagnostisch etiket.
bIj reumatoÔde artrItIs
chilt zeer sterk van de ene patiŽnt tot de andere. Van de
patiŽnten die een eerstelijnstherapie krijgen (zoals metho-
trexaat), vertoont 70% een (goede of matige) klinische
respons. De overige 30% zal een aanvullende behandeling
nodig hebben, bijvoorbeeld biologische geneesmiddelen.
Die biologische medicatie blijkt vrijwel allemaal even effi-
ciŽnt te zijn: 20-30% van de patiŽnten vertoont een goede
respons, 30-40% een matige respons en 30% reageert er
niet op. Die laatsten hebben dus een andere behandeling
nodig.
respons op de behandeling betreft (sommige patiŽnten met
een zeer ernstige ziekte reageren op geen enkele behande-
ling goed), maar er zijn ook specifieke effecten. Bepaalde
patiŽnten reageren niet op behandeling A, maar wel op
behandeling B. Op dit ogenblik kunnen we de respons op
de behandeling nog niet voorspellen. Het therapeutische
beleid is dan ook gebaseerd op trial and error, wat echter
op medisch en economisch vlak niet zo efficiŽnt is.
uitgevoerd op synoviabiopten van patiŽnten met reuma-
toÔde artritis die prospectief werden afgenomen voor en
na het starten van een bepaalde behandeling (2-5). Op die