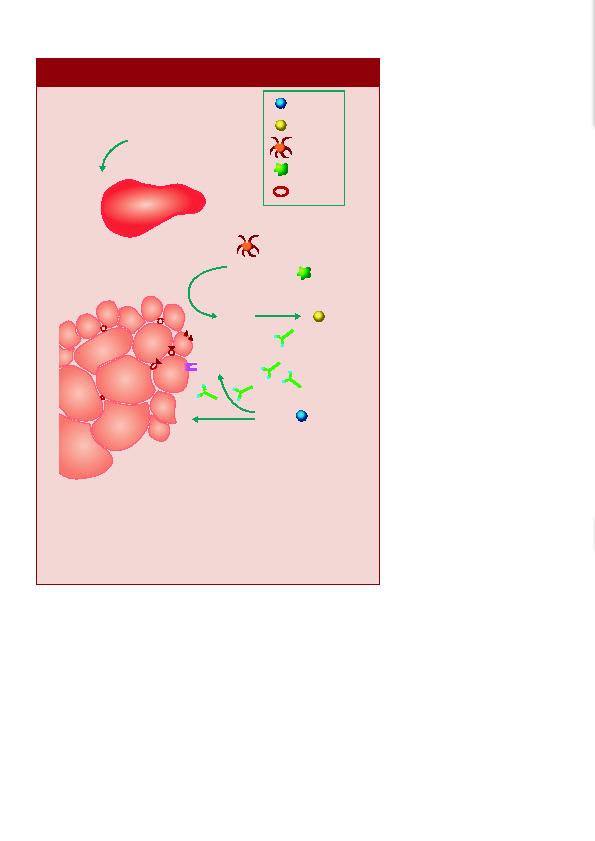
langzaamaan een beeld vormen van
een ziekte-etiologie waarin de TNF-
cytokines een cruciale rol spelen. Geba-
seerd op de huidige kennis ter zake, kan
de mogelijke TNF-gemedieerde opeen-
volging van inflammatoire reacties wor-
den vooropgesteld die leidt tot de ka-
rakteristieke geassocieerde spierschade:
bloedvatnecrose, perifasciculaire spier-
vezelatrofie en inflammatie (Figuur).
handelingen, valt voor patiŽnten met
schijnlijk het meest te verwachten van
de therapeutica die momenteel wor-
den ontwikkeld voor andere auto-
immune aandoeningen. Meer bepaald
heeft het onderzoek naar alternatieve
behandelingen voor reumatoÔde artritis
reeds geleid tot studies in inflamma-
toire myopathieŽn waarbij naar analo-
gie TNFa wordt geneutraliseerd. Tot
nog toe hebben klinische studies de
hoge verwachtingen echter (nog) niet
ingelost. Het uitschakelen van de lym-
fotoxines biedt eveneens een mogelij-
delen TNFa en lymfotoxine a de recep-
toren TNF-R55 en TNF-R75, waardoor
kan verwacht worden dat de activiteit
van beide cytokines tergelijk beÔnvloed
kan worden. Het therapeutische effect
van de competitieve antagonisten van
TNFa-receptoren, meer bepaald eta-
nercept en lenercept, is dus hoogst-
waarschijnlijk terug te brengen tot de
gecombineerde inhibitie van TNFa
en lymfotoxine a. Het RANKL/RANK-
systeem blijkt zowel in reumatoÔde artri-
tis als in inflammatoire myopathieŽn
een belangrijke pathofysiologische rol
te spelen. Denosumab (AMG-162), een
monoklonaal anti-RANKL-antilichaam,
wordt momenteel getest voor de be-
handeling van reumatoÔde artritis, en is
potentieel interessant voor inflamma-
toire myopathieŽn. Het neutraliseren
van BAFF is mogelijk interessant voor
de behandeling van auto-immune aan-
doeningen met een belangrijke humo-
rale component. Hierbij kan in eerste
instantie gedacht worden aan DM,
waar B-cellen in groten getale voorko-
men in het spierweefsel, doch ook in
PM/IBM, waar eveneens aanzienlijke
aantallen gedifferentieerde plasmacel-
len worden aangetroffen. Een anti-
BAFF-antilichaam, LY2127399, wordt
momenteel getest in klinische fase
2-studies voor reumatoÔde artritis.
Het selectief uitschakelen van individu-
ele TNF-cytokines biedt nieuwe perspec-
tieven voor het uitwerken van therapieŽn
voor inflammatoire myopathieŽn die ef-
ficiŽnter zijn dan de huidige systemische
immunosuppressiva. Die laatsten gaan
veelal gepaard met belangrijke bijwer-
kingen en zijn bovendien lang niet werk-
zaam in alle patiŽntengroepen. Verder
onderzoek naar de specifieke rol van
TNF-cytokines bij het ontstaan en de
progressie van de inflammatoire myopa-
thieŽn blijft noodzakelijk.
spierweefselschade geassocieerd met dermatomyositis.
cytokines in de chronische inflammatie in perifasciculaire regio's wordt beschreven. Activering van het complementsysteem leidt
tot depositie van membrane attack complex (MAC) op de bloedvaten en tot daaropvolgende necrose. Monocyte chemoattractant
protein-1 (CCL2) op het bloedvatendotheel rekruteert circulerende inflammatoire cellen, die accumuleren in het perimysium.
Lymfocyten organiseren zich in lymfoÔde structuren onderverdeeld in functionele compartmenten, en produceren lymfotoxines
(LT's), TNFa en CD40L. Deze cytokines rekruteren responsievere immuuncellen, waardoor de perimysiale inflammatie verder
wordt opgebouwd. Dendritische cellen (DC's) produceren IFNa, wat de spiervezels stimuleert om B-cell activating factor (BAFF)
te secreteren. BAFF activeert B-cellen, die reageren met de productie van autoantilichamen. TNFa, vooral geproduceerd door
Th-cellen, veroorzaakt spiervezelatrofie en stimuleert de expressie van Major Histocompatibility Complex I (MHC-I) en
adhesiemolecules op het sarcolemma van de spiervezels.