cytokines TNF, à l'exception du TNFa.
Pour la DM, nous pouvons, progressive-
ment, nous faire une image de l'étiologie
de la maladie, où les cytokines TNF
jouent un rôle crucial. Sur la base des
connaissances actuelles en la matière, il
est possible de déterminer la succession
potentielle de réactions inflammatoires,
médiée par TNF, aboutissant à des dom-
mages musculaires associés caractéris-
tiques: nécrose dans les vaisseaux san-
guins, atrophie de fibres musculaires péri-
fasciculaires et inflammation (Figure).
veaux traitements, les patients avec myo-
pathies inflammatoires ont vraisembla-
blement le plus à attendre de la thérapeu-
tique actuellement mise au point pour
d'autres maladies auto-immunes. Plus
spécifiquement, la recherche de traite-
ments différents pour l'arthrite rhuma-
toïde a d'ores et déjà abouti à des études
des myopathies inflammatoires où, par
analogie, le TNFa est neutralisé. Les
études cliniques n'ont toutefois pas (en-
core) répondu aux attentes importantes à
cet égard. La neutralisation des lympho-
traitement potentielle. Le TNFa et la lym-
photoxine a partagent en outre les récep-
teurs TNF-R55 et TNF-R75, ce qui laisse
présumer qu'il est possible d'influencer
simultanément l'activité des deux cyto-
kines. L'effet thérapeutique des antago-
nistes compétitifs des récepteurs TNFa,
plus spécifiquement l'étanercept et le le-
nercept, peut donc, très probablement,
être ramené à l'inhibition combinée du
TNFa et de la lymphotoxine a. Il apparaît
que le système RANKL/RANK joue un
rôle physiopathologique important, tant
dans l'arthrite rhumatoïde que dans les
myopathies inflammatoires. Le dénosu-
mab (AMG-162), un anticorps anti-
RANKL monoclonal, est actuellement tes-
té pour le traitement de l'arthrite rhuma-
toïde et est potentiellement intéressant
pour les myopathies inflammatoires. La
neutralisation du facteur BAFF peut aussi
s'avérer utile pour le traitement de mala-
dies auto-immunes à forte composante
humorale. A cet égard, on peut penser, en
premier lieu, à la DM, où une proportion
importante de cellules B se manifeste
dans le tissu musculaire. Mais c'est aussi
le cas de la PM/IBM, où se rencontrent
également des quantités considérables de
plasmocytes différenciés. Un anticorps
anti-BAFF, LY2127399, est en ce moment
testé dans des études cliniques de phase II
sur l'arthrite rhumatoïde.
TNF individuelles offre de nouvelles pers-
pectives en ce qui concerne l'élaboration,
pour des myopathies inflammatoires, de
thérapies plus efficaces que les immuno-
suppresseurs systémiques actuels. Ces der-
niers sont généralement associés à des ef-
fets secondaires importants et ne sont pas
non plus performants pour tous les groupes
de patients. Il reste nécessaire de mener
d'autres études sur le rôle spécifique des
cytokines TNF dans l'apparition et la pro-
gression des myopathies inflammatoires.
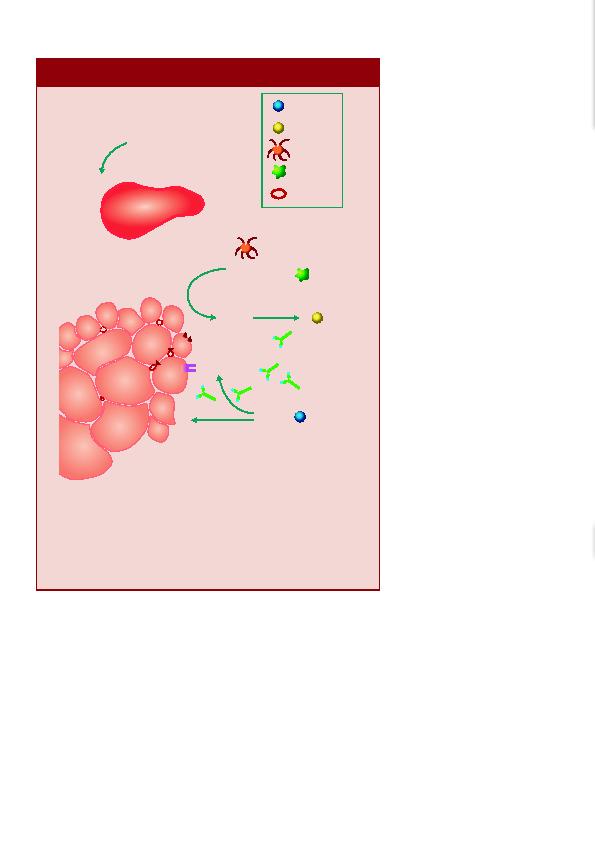
associés à la dermatomyosite.
l'inflammation chronique de régions périfasciculaires a été élaboré sur la base des connaissances actuelles. L'activation du système
complément entraîne le dépôt de MAC (membrane attack complex, complexe d'attaque membranaire) sur les vaisseaux sanguins et
une nécrose consécutive. La protéine chimioattractive monocytaire 1 (CCL2) sur l'endothélium vasculaire recrute des cellules
inflammatoires circulantes, qui s'accumulent dans le périmysium. Les lymphocytes s'organisent en structures lymphoïdes subdivisées
en compartiments fonctionnels et produisent des lymphotoxines (LT), le TNFa et le CD40L. Ces cytokines recrutent des cellules
immunitaires plus sensibles, ce qui se traduit par le développement ultérieur de l'inflammation périmysiale. Des cellules dendritiques
(CD) produisent l'IFNa, ce qui stimule les fibres musculaires en vue de la sécrétion du facteur BAFF (B-cell activating factor). Le
facteur BAFF active des cellules B, qui réagissent en produisant des autoanticorps. Le TNFa, essentiellement produit par des cellules
Th, provoque une atrophie des fibres musculaires et stimule l'expression du complexe MHC-I (Major Histocompatibility Complex I,
complexe majeur d'histocompatibilité I) et de molécules d'adhésion sur le sarcolemme des fibres musculaires.