zensiz da¤>ld>¤>ndan asimetrik olarak yerleflmifltir.
Bu nedenle su molekülünde sürekli dipol karakterini
veren a¤>r yüklü 2 noktan>n oluflumu, molekülün be-
lirli flekilde polarize olmas>na yol açar (fiekil 1.1)
flans> vard>r. Bu nedenle esas yap>, içerisinde bir su
molekülü ile koordine olmufl 4 su molekülü tetrahed-
ral yap>
ifade edilir. Buzda %100, s>v> haldeki suda (oda >s>s>n-
da) %70 ve hatta 100 °C'de %50 daha su molekülü,
benzeri düzende bir yap> meydana getirmek üzere
pefl pefle hidrojen köprüleriyle ba¤lanm>fllard>r. Ba¤l>
bir su molekülünün semikristal alanda ortalama kal>fl
süresi 10
har>
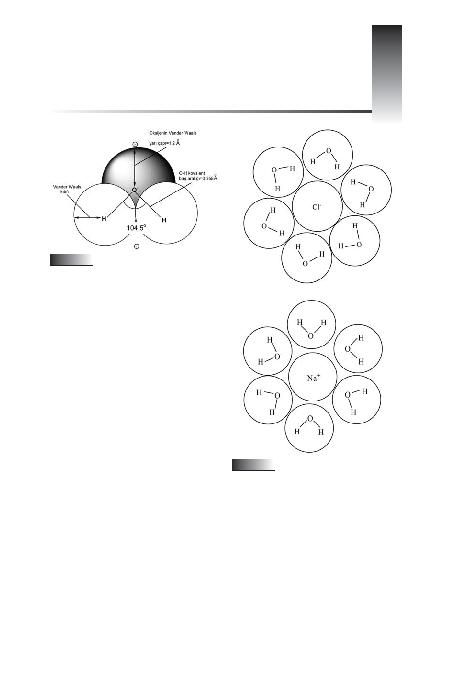
nurlar ki, burada katyonlar su molekülünün negatif
yük merkezini (oksijen), anyonlar da su dipolünün
pozitif yük merkezini (hidrojen) çeker. Bu suretle, su
zerrecikleri iyon etraf>nda merkezi simetrik bir kuru-
lufla (birikime) ve ayn> zamanda saf suyun tetrahed-
ral yap>s>ndan tamamen farkl> olan bir su molekülü-
tize olmufl sodyum ve klor iyonlar> görülmektedir.
büyük iyonlardan daha kuvvetli ba¤larlar. Biyolojik
karfl>laflt>rma için etkin iyon yar>çap>, yani hidratize
durumdaki iyonun yar>çap> önemlidir. Örne¤in, hid-
ratize sodyum iyonu (2.56 Ċ), hidratize potasyum
iyonunun yar>çap>ndan (1.98 Ċ) daha büyük bir yar>-
çapa sahip oldu¤u halde, hidratize olmayan iyonlar>n
yar>çaplar>nda tersine bir durum vard>r.