Elektrottan çözeltiye geçen H iyonlar> say>s>, çö-
zeltide bafllang>çta bulunan H iyonlar> say>s> ile ters
orant>l>d>r. Dolay>s>yla elektrotun negatif yükü, çö-
zeltinin H iyonlar> konsantrasyonuna ba¤l>d>r. Di¤er
bir ifade ile hidrojen elektrotun elektriksel potansiye-
li, içine bu elektrotu dald>rd>¤>m>z çözeltinin hidrojen
iyonlar> konsantrasyonuna ba¤l>d>r. E¤er hidrojen
elektrot, elektriksel potansiyeli bilinen baflka bir elek-
trot ile ba¤lan>rsa, bu iki elektrot aras>ndaki potansi-
yel fark> bir potansiyometre arac>l>¤>yla kolayl>kla öl-
çülebilir.
7.2. Kolorimetrik Metod
Bu metod, baz> boya maddelerinin belirli pH de¤erle-
rinde renk de¤ifltirmesi esas>na dayan>r. Bu madde-
ler, ilave edildikleri çözeltilerin asit veya baz oldu¤u-
nu gösterirler. Çözeltilerde ortam>n [H
+
] iyon kon-
santrasyonuna göre renk de¤ifltiren maddelere indi-
katör
denir. Bunlar asitlerle bazlar>n titrasyonlar>nda
da nötralizasyonu göstermeleri amac>yla kullan>l>r-
lar.
Tüpte bir miktar tükürü¤e bir damla fenolftalein
damlat>l>rsa tükürü¤ün renksiz kalmas> pH's>n>n
8.3'den küçük oldu¤unu gösterir. Di¤er bir tüpte ay-
n> tükürükten al>nan bir baflka örnek üzerine bir dam-
la turnusol damlat>l>nca da renk mavi olursa pH's>
7'den büyük demektir. O halde turnusol ve fenolfta-
lein indikatörleri kullan>larak tükürü¤ün pH's>n>n 7-
8.3 aras>nda oldu¤u bulunur.
Not: Fenolftalein, asit ortamda renksiz bazik or-
tamda ise k>rm>z>d>r, pH s>n>rlar> 8.3-10.0 d>r. Turnu-
sol ise, asit ortamda k>rm>z> bazik ortamda ise mavi-
dir, pH s>n>rlar> yaklafl>k olarak 7.0 dir.
dönüm
noktas>
denir. Tek dönüm noktal> indikatörler oldu-
¤u gibi, çift dönüm noktal> indikatörler de vard>r.
Bunlar hem asit, hem de baz grubuna sahip organik
asitlerdir. pH s>n>r> içerisinde renk de¤ifltirir-
ler. 3-5 ve 11-13 gibi.
8. AMFOLELEKTROL
Hem asitlerle hem de bazlarla tuz oluflturabilen mad-
delere amfoter elektrolitler veya amfolitler denir.
Bunlar asit ortamda katyonlar, bazik ortamda ise an-
yonlar olufltururlar. Bir amfolit, belirli bir pH'da ayn>
say>da negatif ve pozitif yük tafl>r. Bu pH'ya amfolitin
izoelektrik nokta pH's>
denir. Bir amfolit asit reaksi-
yonda katoda, alkalik reaksiyonda anoda göç etti¤i
halde, izoelektrik noktada elektrik ak>m> ile hareket
etmez.
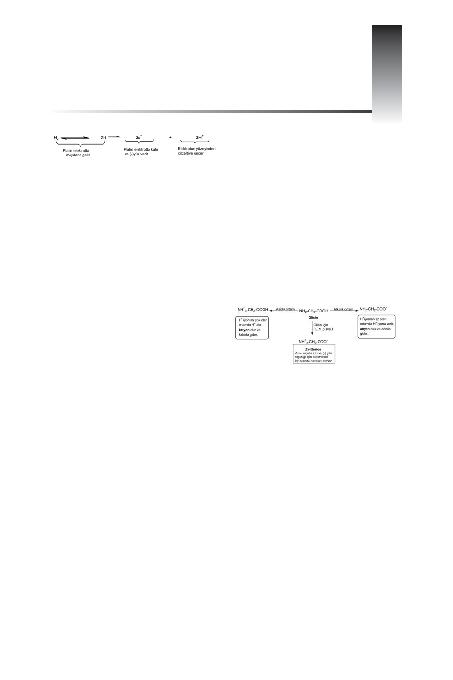
Örne¤in, glisin alkalik reaksiyonda anyon (NH
2
-
CH
2
-COO
-
) olarak anoda, asit reaksiyonda ise katyon
(NH
+
3
-CH
2
-COOH) halinde katoda gider; pH= 6.1'de
elektriksel alanda hareket etmez (NH
+
3
-CH
2
-COO
-
).
Yani glisinin izoelektrik nokta pH's> 6.1'dir (<.E.N. pH
=6.1).
9. TAMPON ÇÖZELT
fl>m>
(pH:7) ve di¤erine de yine ekimolar oranda CH
3
.CO-
OH ve NH
3
kar>fl>m> (pH:7) konup, her ikisine de bi-
rer damla 0.1 N HCl konursa HCl+NaOH kar>fl>m>n>n
pH de¤eri aside kayd>¤> halde CH
3
.COOH+NH
2
ka-
r>fl>m>n>n pH's> de¤iflmez. Yine 0.1 N NaOH'den birer
damla eklenmesi de ayn> sonucu ortaya ç>kar>r. Ben-
zer flekilde az miktarda bir asit, suya ve kan serumu-
na ilave edilse, su h>zla asit reaksiyonu gösterdi¤i hal-
de serum nötr kal>r. Bunun nedeni serumda reaksiyo-
nun aside çevrilmesine engel olan maddelerin yani
tamponlar>n bulunmas>d>r. Tampon maddeler, H
+
veya OH
-
iyonlar>n>n konsantrasyonunu sabit tutan
veya hiç olmazsa pH de¤iflmelerini azaltan maddeler-
dir. Bir s>v>da ne kadar çok tampon varsa, o oranda
çok asit veya baz, s>v>n>n pH's>nda büyük bir fark
meydana getirmeksizin eklenebilir. En iyi tampon çö-
zeltilerde asit baz oran> 10
-1
-10'dur. En kuvvetli tam-
pon çözeltilerde pH de¤eri pK
a
civar>nda bulunur
(pH=pK
a
±1).
BÖLÜM 1
B
21
